Tabelul periodic al elementelor

Fiecare element chimic are un nume unic și o abreviere, cunoscută sub numele de simbol chimic, care este o reprezentare prescurtată a numelui elementului.
Ce este tabelul periodic?
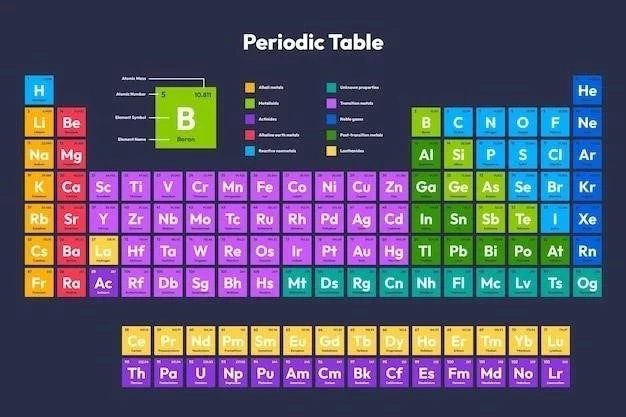
Tabelul periodic al elementelor, adesea denumit pur și simplu tabelul periodic, este o reprezentare organizată a tuturor elementelor chimice cunoscute. Această reprezentare este fundamentală pentru înțelegerea chimiei, deoarece prezintă o imagine de ansamblu a relațiilor dintre elemente și proprietățile lor. Tabelul periodic este un instrument indispensabil pentru chimiști, fizicieni și alți oameni de știință, oferind o bază pentru înțelegerea comportamentului materiei la nivel atomic.
Tabelul periodic este organizat în funcție de numărul atomic al elementelor, care reprezintă numărul de protoni din nucleul unui atom. Elementele sunt aranjate în rânduri, numite perioade, și coloane, numite grupuri, în funcție de proprietățile lor chimice similare. Această organizare reflectă legea periodică, care afirmă că proprietățile elementelor variază periodic în funcție de numărul atomic;
Tabelul periodic este un instrument esențial pentru studierea chimiei, oferind o modalitate sistematică de a organiza și de a înțelege proprietățile elementelor. Este un instrument vital pentru chimiști, fizicieni și alți oameni de știință, oferind o bază pentru înțelegerea comportamentului materiei la nivel atomic.
Elemente chimice⁚ Blocurile de construcție ale materiei
Elementele chimice sunt substanțele fundamentale din care este compusă toată materia. Acestea sunt substanțe pure care nu pot fi descompuse în substanțe mai simple prin mijloace chimice. Fiecare element este caracterizat printr-un număr atomic unic, care reprezintă numărul de protoni din nucleul atomului său. De exemplu, hidrogenul (H) are un număr atomic de 1, în timp ce oxigenul (O) are un număr atomic de 8.
Elementele chimice sunt blocurile de construcție ale universului, formând o gamă largă de substanțe, de la cele mai simple, cum ar fi apa (H2O), la cele mai complexe, cum ar fi proteinele și ADN-ul. Ele joacă un rol esențial în toate procesele chimice și biologice, de la formarea stelelor la funcționarea celulelor vii.
Înțelegerea elementelor chimice este esențială pentru înțelegerea chimiei și a lumii din jurul nostru. Studiul elementelor ne permite să explorăm natura materiei, să înțelegem reacțiile chimice și să dezvoltăm noi materiale și tehnologii.
Numele elementelor și abrevierile lor
Fiecare element chimic are un nume unic și o abreviere, cunoscută sub numele de simbol chimic, care este o reprezentare prescurtată a numelui elementului. Simbolurile chimice sunt utilizate pe scară largă în chimie pentru a reprezenta elementele în formule chimice, ecuații chimice și alte notații chimice.
Majoritatea simbolurilor chimice sunt derivate din numele latine ale elementelor. De exemplu, simbolul pentru hidrogen este “H”, care provine din cuvântul latin “hydrogenium”. Simbolul pentru oxigen este “O”, care provine din cuvântul latin “oxygenium”. Unele simboluri chimice sunt derivate din numele engleze ale elementelor, cum ar fi simbolul pentru fier “Fe”, care provine din cuvântul englez “iron”.
Simbolurile chimice sunt de obicei formate dintr-o singură literă, care este scrisă cu majusculă, sau din două litere, prima fiind scrisă cu majusculă, iar a doua cu minusculă. De exemplu, simbolul pentru carbon este “C”, iar simbolul pentru calciu este “Ca”.
Simbolurile chimice⁚ O notație universală
Simbolurile chimice reprezintă un sistem de notație universală în chimie, permițând o comunicare clară și concisă între chimiști din întreaga lume. Indiferent de limba vorbită, simbolurile chimice rămân aceleași, asigurând o înțelegere comună a formulelor și ecuațiilor chimice.
Utilizarea simbolurilor chimice simplifică scrierea și înțelegerea formulelor chimice. De exemplu, formula chimică a apei este H2O, care indică faptul că o moleculă de apă este formată din doi atomi de hidrogen (H) și un atom de oxigen (O). Fără simbolurile chimice, ar fi mult mai dificil de scris și de înțeles această formulă.
Simbolurile chimice sunt esențiale pentru a descrie reacțiile chimice. De exemplu, ecuația chimică pentru reacția dintre hidrogen și oxigen pentru a forma apă este⁚ 2H2 + O2 → 2H2O. Această ecuație arată că doi atomi de hidrogen reacționează cu un atom de oxigen pentru a forma două molecule de apă. Simbolurile chimice permit o reprezentare clară și concisă a reacțiilor chimice, facilitând înțelegerea și interpretarea lor.
Organizarea tabelului periodic⁚ Legea periodică
Tabelul periodic al elementelor este organizat în funcție de legea periodică, care afirmă că proprietățile chimice ale elementelor sunt o funcție periodică a numărului lor atomic. Aceasta înseamnă că elementele cu proprietăți similare sunt grupate împreună în tabel.
Tabelul periodic este împărțit în perioade și grupuri. Perioadele sunt rândurile orizontale ale tabelului, iar grupurile sunt coloanele verticale. Elementele din aceeași perioadă au același număr de niveluri de energie electronice, în timp ce elementele din același grup au același număr de electroni de valență, adică electroni în ultimul nivel de energie.
Organizarea tabelului periodic reflectă o tendință periodică a proprietăților chimice ale elementelor. De exemplu, elementele din aceeași grupă au proprietăți chimice similare, deoarece au același număr de electroni de valență. Această tendință periodică permite predicția proprietăților chimice ale unui element pe baza poziției sale în tabelul periodic.
Numărul atomic și greutatea atomică
Fiecare element chimic este identificat prin numărul său atomic, care reprezintă numărul de protoni din nucleul atomului. Numărul atomic este un număr întreg pozitiv, care se găsește de obicei în colțul din stânga sus al simbolului chimic al elementului în tabelul periodic. De exemplu, numărul atomic al hidrogenului este 1, iar numărul atomic al oxigenului este 8.
Greutatea atomică a unui element este o măsură a masei sale atomice relative, care se bazează pe masa atomului de carbon-12, considerat ca având o masă atomică de 12 unități de masă atomică (u.m.a.). Greutatea atomică a unui element se găsește de obicei sub simbolul chimic al elementului în tabelul periodic. De exemplu, greutatea atomică a hidrogenului este 1,008 u.m.a., iar greutatea atomică a oxigenului este 15,999 u.m.a.
Numărul atomic și greutatea atomică sunt proprietăți fundamentale ale elementelor chimice și joacă un rol important în înțelegerea structurii atomice și a proprietăților chimice ale elementelor.
Proprietățile chimice ale elementelor
Proprietățile chimice ale elementelor sunt determinate de configurația electronică a atomilor lor, care descrie modul în care electronii sunt aranjați în jurul nucleului. Această configurație electronică influențează modul în care atomii unui element interacționează cu alți atomi, formând legături chimice și participând la reacții chimice.
De exemplu, metalele au tendința de a pierde electroni, formând cationi, în timp ce nemetalele au tendința de a câștiga electroni, formând anioni. Această diferență de comportament explică de ce metalele sunt bune conductoare de electricitate și căldură, în timp ce nemetalele sunt izolatoare. Alte proprietăți chimice importante includ electronegativitatea, afinitatea electronică și energia de ionizare, care reflectă tendința unui atom de a atrage electroni, de a câștiga electroni sau de a pierde electroni, respectiv.
Înțelegerea proprietăților chimice ale elementelor este esențială pentru a prezice modul în care acestea se vor comporta în reacțiile chimice și pentru a proiecta noi materiale și procese chimice.
Formula chimică și reacțiile chimice
Formula chimică este o reprezentare simbolică a unui compus chimic, care indică tipurile și numărul de atomi din molecula respectivă. De exemplu, formula chimică a apei este $H_2O$, ceea ce indică faptul că o moleculă de apă este formată din doi atomi de hidrogen ($H$) și un atom de oxigen ($O$).
Reacțiile chimice sunt procese care implică rearanjarea atomilor și moleculelor, rezultând formarea de noi substanțe. Ecuatiile chimice sunt utilizate pentru a reprezenta reacțiile chimice, arătând reactanții (substanțele inițiale) și produsele (substanțele finale) ale reacției. De exemplu, ecuația chimică pentru reacția de ardere a metanului este⁚
$CH_4 + 2O_2 ightarrow CO_2 + 2H_2O$
Această ecuație arată că un mol de metan ($CH_4$) reacționează cu doi moli de oxigen ($O_2$) pentru a produce un mol de dioxid de carbon ($CO_2$) și doi moli de apă ($H_2O$).
Formula chimică și ecuațiile chimice sunt instrumente esențiale pentru înțelegerea și prezicerea comportamentului substanțelor în reacțiile chimice.
Compuși chimici⁚ Combinarea elementelor
Compușii chimici sunt substanțe formate din două sau mai multe elemente chimice unite prin legături chimice. Legăturile chimice sunt forțe de atracție care țin atomii împreună, formând molecule sau structuri ionice. Există mai multe tipuri de legături chimice, inclusiv legăturile covalente, ionice și metalice.
Legăturile covalente se formează prin împărțirea electronilor între atomi, de exemplu, în moleculele de apă ($H_2O$) sau dioxid de carbon ($CO_2$). Legăturile ionice se formează prin transferul de electroni de la un atom la altul, creând ioni cu sarcini opuse care se atrag reciproc, de exemplu, în clorura de sodiu ($NaCl$). Legăturile metalice se formează între atomii metalelor, unde electronii sunt delocalizați, creând o “mare electronică” care leagă atomii metalici.
Compușii chimici sunt extrem de numeroși și variați, având o gamă largă de proprietăți fizice și chimice. De exemplu, apa este un compus esențial pentru viață, în timp ce clorura de sodiu este un compus important în industria alimentară și chimică. Studiul compușilor chimici este esențial pentru înțelegerea chimiei și a lumii din jurul nostru.
Importanța tabelului periodic în educația chimică
Tabelul periodic este un instrument esențial în educația chimică, oferind o bază solidă pentru înțelegerea chimiei elementelor și a interacțiunilor dintre ele. El facilitează o abordare sistematică a studiului chimiei, permițând elevilor să înțeleagă relațiile între elemente și proprietățile lor, precum și să prezică comportamentul chimic al elementelor.
Prin organizarea elementelor în funcție de numărul atomic și de proprietățile lor chimice, tabelul periodic facilitează memorarea și înțelegerea informațiilor despre elemente. De asemenea, permite predicția proprietăților chimice ale elementelor necunoscute sau ale elementelor care nu au fost încă descoperite. Prin studiul tabelului periodic, elevii pot dezvolta o înțelegere profundă a legăturilor chimice, a reacțiilor chimice și a formării compușilor.
Tabelul periodic este o resursă indispensabilă pentru elevii de toate nivelurile, de la cei care încep studiul chimiei la cei care se pregătesc pentru o carieră în domeniu. El oferă o bază solidă pentru înțelegerea chimiei, a lumii din jurul nostru și a tehnologiilor moderne care se bazează pe chimie.
Aplicații ale tabelului periodic în știință și tehnologie
Tabelul periodic are aplicații vaste în știință și tehnologie, influențând o gamă largă de domenii, de la dezvoltarea de noi materiale la înțelegerea proceselor biologice. De la descoperirea de noi elemente la studierea reacțiilor chimice, tabelul periodic este un instrument indispensabil pentru cercetarea științifică.
În chimie, tabelul periodic este utilizat pentru a prezice reacțiile chimice, a determina proprietățile compușilor și a dezvolta noi materiale cu proprietăți specifice. De exemplu, în industria farmaceutică, tabelul periodic este esențial pentru sinteza de noi medicamente, iar în industria materialelor, este utilizat pentru a crea materiale cu rezistență ridicată, conductivitate electrică îmbunătățită sau proprietăți magnetice specifice.
În domeniul biologiei, tabelul periodic este utilizat pentru a studia rolul elementelor în organismele vii. De exemplu, tabelul periodic ajută la înțelegerea funcției metalelor în enzime, a rolului fosforului în ADN și a importanței calciului în oase. În plus, tabelul periodic este utilizat în geologie pentru a studia compoziția rocilor și a mineralelor, precum și în astrofizică pentru a analiza compoziția stelelor și a planetelor.
Tabelul periodic al elementelor⁚ O introducere în chimia elementelor
Concluzie⁚ Tabelul periodic ⎯ un instrument esențial pentru înțelegerea chimiei
Tabelul periodic al elementelor este un instrument esențial pentru înțelegerea chimiei, oferind o imagine de ansamblu asupra elementelor care alcătuiesc universul. Organizarea sa logică, bazată pe legea periodică, permite prezicerea proprietăților elementelor și a modului în care acestea interacționează între ele. Simbolurile chimice, abrevieri concise ale numelor elementelor, joacă un rol crucial în exprimarea formulelor chimice și a reacțiilor chimice, facilitând comunicarea și înțelegerea chimiei.
Tabelul periodic este un instrument dinamic, în continuă evoluție, cu descoperirea de noi elemente și rafinarea cunoștințelor noastre despre elementele existente. Este un instrument de neprețuit pentru cercetarea științifică, educație și tehnologie, contribuind la dezvoltarea de noi materiale, medicamente și tehnologii. Înțelegerea tabelului periodic deschide uși către o lume fascinantă de cunoștințe și inovații, oferind o perspectivă unică asupra lumii din jurul nostru.
De la descoperirea de noi elemente la studierea reacțiilor chimice, tabelul periodic este un instrument indispensabil pentru cercetarea științifică. Înțelegerea sa este esențială pentru a decripta complexitatea lumii chimice, oferind un instrument de neprețuit pentru a progresa în domeniul științei și tehnologiei.
Articolul oferă o prezentare generală utilă a tabelului periodic, evidențiând importanța sa în chimie. Explicația legii periodice este clară și concisă. Aș sugera adăugarea unor informații suplimentare despre proprietățile chimice ale elementelor, cum ar fi electronegativitatea, potențialul de ionizare și afinitatea electronică. De asemenea, ar fi util să se menționeze existența unor elemente radioactive.
Articolul oferă o prezentare generală utilă a tabelului periodic, evidențiind importanța sa în chimie. Explicația legii periodice este clară și concisă. Aș sugera adăugarea unor informații suplimentare despre istoria descoperirii tabelului periodic și despre contribuțiile unor oameni de știință importanți, cum ar fi Dmitri Mendeleev. De asemenea, ar fi util să se menționeze existența unor variante ale tabelului periodic, cum ar fi tabelul periodic lung.
Articolul prezintă o introducere clară și concisă în conceptul tabelului periodic, evidențiând importanța sa în chimie. Explicația legii periodice este bine structurată și ușor de înțeles. Aș sugera adăugarea unei secțiuni despre aplicațiile practice ale tabelului periodic, de exemplu, în industria chimică sau în dezvoltarea noilor tehnologii. De asemenea, ar fi util să se menționeze existența unor elemente rare, cum ar fi metalele prețioase.
Articolul este bine scris și ușor de înțeles, oferind o introducere clară și concisă în conceptul tabelului periodic. Explicația legii periodice este bine structurată și ușor de înțeles. Aș sugera adăugarea unor informații suplimentare despre proprietățile chimice ale elementelor, cum ar fi electronegativitatea, potențialul de ionizare și afinitatea electronică. De asemenea, ar fi util să se menționeze existența unor elemente radioactive.
Articolul este bine scris și accesibil unui public larg. Explicația legii periodice este clară și concisă, iar exemplele oferite sunt relevante. Aș sugera adăugarea unor informații suplimentare despre proprietățile chimice ale elementelor, cum ar fi electronegativitatea, potențialul de ionizare și afinitatea electronică. De asemenea, ar fi util să se menționeze existența unor elemente radioactive.
Articolul este bine scris și accesibil unui public larg. Explicația legii periodice este clară și concisă, iar exemplele oferite sunt relevante. Aș sugera adăugarea unei secțiuni despre aplicațiile practice ale tabelului periodic, de exemplu, în industria farmaceutică sau în dezvoltarea noilor materiale. De asemenea, ar fi util să se menționeze existența unor elemente sintetice, care nu se găsesc în natură.
Articolul este bine scris și ușor de înțeles, oferind o introducere clară și concisă în conceptul tabelului periodic. Explicația legii periodice este bine structurată și ușor de înțeles. Aș sugera adăugarea unor informații suplimentare despre aplicațiile practice ale tabelului periodic, de exemplu, în industria chimică sau în dezvoltarea noilor tehnologii. De asemenea, ar fi util să se menționeze existența unor elemente rare, cum ar fi metalele prețioase.
Articolul este bine scris și accesibil unui public larg. Explicația legii periodice este clară și concisă, iar exemplele oferite sunt relevante. Aș sugera adăugarea unei secțiuni despre istoria descoperirii tabelului periodic și despre contribuțiile unor oameni de știință importanți, cum ar fi Dmitri Mendeleev. De asemenea, ar fi util să se menționeze existența unor variante ale tabelului periodic, cum ar fi tabelul periodic lung.
Articolul prezintă o introducere clară și concisă în conceptul tabelului periodic, evidențiind importanța sa în chimie. Explicația legii periodice este bine structurată și ușor de înțeles. Totuși, aș sugera o extindere a secțiunii despre elementele chimice, oferind mai multe exemple concrete și detalii despre proprietățile lor specifice. Ar fi util să se includă și o imagine a tabelului periodic, pentru a facilita vizualizarea structurii sale.
Articolul prezintă o introducere clară și concisă în conceptul tabelului periodic, evidențiând importanța sa în chimie. Explicația legii periodice este bine structurată și ușor de înțeles. Aș sugera adăugarea unei secțiuni despre istoria descoperirii tabelului periodic și despre contribuțiile unor oameni de știință importanți, cum ar fi Dmitri Mendeleev. De asemenea, ar fi util să se menționeze existența unor variante ale tabelului periodic, cum ar fi tabelul periodic lung.