Ce sunt elementele din tabelul periodic?

Ce sunt elementele din tabelul periodic?
Elementele chimice sunt substanțe pure care nu pot fi descompuse în substanțe mai simple prin metode chimice obișnuite. Fiecare element este definit prin numărul său atomic, care reprezintă numărul de protoni din nucleul atomului său.
Ce sunt elementele din tabelul periodic?
Elementele chimice
Elementele chimice sunt substanțe pure care nu pot fi descompuse în substanțe mai simple prin metode chimice obișnuite. Fiecare element este definit prin numărul său atomic, care reprezintă numărul de protoni din nucleul atomului său. De exemplu, hidrogenul (H) are numărul atomic 1, ceea ce înseamnă că fiecare atom de hidrogen are un singur proton în nucleul său.
Elementele chimice sunt blocurile de construcție ale materiei. Ele se combină pentru a forma compuși, care sunt substanțe formate din două sau mai multe elemente diferite. De exemplu, apa (H2O) este un compus format din două atomi de hidrogen și un atom de oxigen.
Există peste 100 de elemente chimice cunoscute, dintre care 94 apar în mod natural pe Pământ. Restul au fost create artificial în laboratoare. Elementele chimice sunt organizate într-un tabel numit tabelul periodic, care le ordonează în funcție de proprietățile lor chimice și fizice.
Tabelul periodic este un instrument esențial pentru chimiști și alți oameni de știință, deoarece le permite să înțeleagă și să prezică comportamentul elementelor chimice. El oferă o imagine de ansamblu a relațiilor dintre elemente, ajutând la înțelegerea reacțiilor chimice și a proprietăților compușilor.
Ce sunt elementele din tabelul periodic?
Tabelul periodic
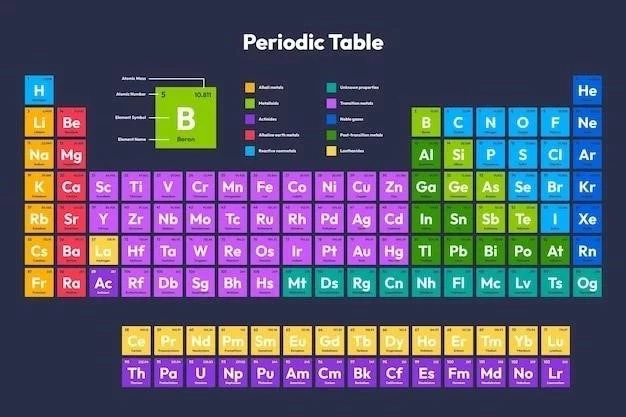
Tabelul periodic este o reprezentare grafică a tuturor elementelor chimice cunoscute, organizate în funcție de numărul lor atomic crescător și de proprietățile lor chimice recurente. A fost dezvoltat de chimistul rus Dmitri Mendeleev în 1869, și de atunci a fost îmbunătățit și extins pentru a include toate elementele descoperite.
Tabelul periodic are o structură specifică. Elementele sunt aranjate în șapte rânduri orizontale, numite perioade, și în 18 coloane verticale, numite grupe. Numărul perioadei indică nivelul energetic principal al electronilor de valență ai atomilor din acea perioadă. Numărul grupei indică numărul de electroni de valență ai atomilor din acea grupă.
Tabelul periodic este un instrument esențial pentru chimiști și alți oameni de știință, deoarece le permite să înțeleagă și să prezică comportamentul elementelor chimice. El oferă o imagine de ansamblu a relațiilor dintre elemente, ajutând la înțelegerea reacțiilor chimice și a proprietăților compușilor.
De exemplu, elementele din aceeași grupă au proprietăți chimice similare, deoarece au același număr de electroni de valență. Elementele din aceeași perioadă au proprietăți chimice diferite, deoarece au niveluri energetice diferite ale electronilor de valență.
Ce sunt elementele din tabelul periodic?
Grupe și perioade
Tabelul periodic este organizat în șapte rânduri orizontale, numite perioade, și în 18 coloane verticale, numite grupe. Perioadele reprezintă nivelurile principale de energie ale electronilor din atom. Numărul perioadei indică nivelul energetic principal al electronilor de valență ai atomilor din acea perioadă. De exemplu, elementele din perioada 1 au electronii de valență pe nivelul energetic principal 1, iar elementele din perioada 2 au electronii de valență pe nivelul energetic principal 2.
Grupele, pe de altă parte, reprezintă numărul de electroni de valență ai atomilor din acea grupă. Elementele din aceeași grupă au același număr de electroni de valență, ceea ce explică de ce au proprietăți chimice similare. De exemplu, elementele din grupa 1 (metalele alcaline) au un singur electron de valență, ceea ce le conferă reactivitate chimică ridicată. Elementele din grupa 17 (halogenii) au șapte electroni de valență, ceea ce le conferă o tendință de a câștiga un electron pentru a forma ioni negativi.
Organizarea elementelor în perioade și grupe facilitează studiul și înțelegerea proprietăților chimice ale elementelor. Tabelul periodic oferă o imagine de ansamblu a relațiilor dintre elemente, ajutând la înțelegerea reacțiilor chimice și a proprietăților compușilor.
Ce sunt elementele din tabelul periodic?
Numărul atomic și masa atomică
Numărul atomic al unui element, notat cu simbolul $Z$, reprezintă numărul de protoni din nucleul atomului său. Numărul atomic este un număr întreg pozitiv care identifică în mod unic un element chimic. De exemplu, atomul de hidrogen are un singur proton, deci numărul său atomic este 1. Atomul de carbon are șase protoni, deci numărul său atomic este 6. Numărul atomic este o proprietate fundamentală a unui element, care determină proprietățile sale chimice.
Masa atomică, notată cu simbolul $A$, reprezintă masa medie a atomilor unui element, exprimată în unități de masă atomică (u.m.a.). Masa atomică ia în considerare atât masa protonilor și neutronilor din nucleul atomului, cât și masa electronilor din învelișul electronic. De exemplu, masa atomică a carbonului este 12.011 u.m.a., ceea ce înseamnă că un atom de carbon are o masă medie de 12.011 ori mai mare decât masa unui atom de hidrogen. Masa atomică este o proprietate importantă, deoarece reflectă abundența izotopilor unui element.
Numărul atomic și masa atomică sunt informații esențiale pentru înțelegerea structurii atomice și a proprietăților chimice ale elementelor. Aceste informații sunt prezentate în tabelul periodic pentru fiecare element, facilitând studiul și înțelegerea chimiei.
Clasificarea elementelor
Metalele sunt elemente care prezintă în general o bună conductivitate electrică și termică, sunt maleabile și ductile, și au un luciu metalic caracteristic.
Metale
Metalele sunt o categorie largă de elemente chimice care se caracterizează printr-o serie de proprietăți fizice și chimice comune. Aceste proprietăți sunt determinate de structura lor electronică, care are ca rezultat o tendință de a pierde electroni și de a forma cationi.
Una dintre cele mai evidente caracteristici ale metalelor este conductivitatea electrică și termică ridicată. Aceasta se datorează prezenței electronilor liberi în structura lor atomică, care pot transporta cu ușurință energie electrică și termică. De asemenea, metalele sunt în general maleabile, adică pot fi deformate în foi subțiri, și ductile, adică pot fi trase în fire subțiri.
Alte proprietăți comune ale metalelor includ⁚
- Luciu metalic⁚ Metalele au un luciu caracteristic, reflectând lumina într-un mod specific.
- Densitate mare⁚ Metalele sunt în general dense, cu o masă mare pe unitatea de volum.
- Punct de topire și fierbere ridicat⁚ Metalele au puncte de topire și fierbere ridicate, ceea ce indică o legătură puternică între atomii lor.
- Rezistență mecanică⁚ Metalele sunt în general rezistente la stresuri mecanice, putând suporta sarcini mari fără a se deforma.
Metalele sunt utilizate pe scară largă în diverse industrii, de la construcții și automobile până la electronică și medicină. Proprietățile lor unice le fac materiale esențiale pentru o gamă largă de aplicații.
Nonmetale
Nonmetalele sunt o categorie de elemente chimice care se caracterizează prin proprietăți fizice și chimice distincte de metale. Ele se găsesc în partea dreaptă a tabelului periodic și se disting prin lipsa luciu metalic, conductivitate electrică și termică scăzută, precum și puncte de topire și fierbere relativ scăzute.
Nonmetalele sunt în general fragile și nu pot fi deformate în foi subțiri sau trase în fire. Ele au o tendință de a câștiga electroni în reacții chimice, formând anioni. Structura lor electronică este caracterizată de o tendință de a completa stratul de valență, ceea ce le conferă proprietăți chimice specifice.
Nonmetalele prezintă o varietate de stări fizice la temperatura camerei⁚
- Gaze⁚ Exemple de nonmetale gazoase includ oxigenul (O2), azotul (N2), clorul (Cl2) și fluorul (F2).
- Solide⁚ Carbonul (C), fosforul (P), sulful (S) și iodul (I) sunt exemple de nonmetale solide.
- Lichid⁚ Bromul (Br2) este singurul nonmetal lichid la temperatura camerei.
Nonmetalele joacă roluri esențiale în diverse procese chimice și biologice. De exemplu, oxigenul este esențial pentru respirația organismelor vii, iar azotul este un component major al atmosferei.
Metaloizi
Metaloizii, cunoscuți și sub numele de semimetale, sunt o categorie de elemente chimice care prezintă proprietăți intermediare între metale și nonmetale. Această categorie se caracterizează printr-o conductivitate electrică variabilă, care poate fi influențată de factori precum temperatura și impuritățile. Metaloizii au o tendință de a forma legături covalente, dar pot prezenta și caracteristici metalice în anumite condiții.
Metaloizii se găsesc pe linia de separare dintre metale și nonmetale în tabelul periodic. Această poziție strategică le conferă un comportament chimic complex și o gamă largă de aplicații. De exemplu, siliciul (Si) este un semiconductor esențial în industria electronică, utilizat în fabricarea cipurilor de calculator și a panourilor solare.
Metaloizii au o importanță semnificativă în diverse domenii, incluzând⁚
- Electronică⁚ Siliciul (Si), germaniul (Ge) și arseniul (As) sunt utilizate în fabricarea dispozitivelor semiconductoare, cum ar fi tranzistoarele, diodele și microcipurile;
- Sticla⁚ Borul (B) este un component esențial al sticlei, conferindu-i rezistență și durabilitate.
- Aliaje⁚ Antimoniul (Sb) este adăugat la aliajele de plumb pentru a le îmbunătăți duritatea și rezistența la coroziune.
Proprietățile unice ale metaloizilor le permit să fie utilizate în diverse aplicații tehnologice și industriale, contribuind la progresul tehnologic în diverse domenii.
Grupe importante din tabelul periodic
Tabelul periodic prezintă o serie de grupe importante, fiecare caracterizată prin proprietăți chimice și fizice distincte, reflectând configurația electronică a elementelor din cadrul lor.
Metalele alcaline
Metalele alcaline formează prima coloană a tabelului periodic (grupa 1), cu excepția hidrogenului, care este un nemetal. Aceste metale sunt foarte reactive, având o singură electron în stratul de valență, ceea ce le conferă o tendință puternică de a pierde acest electron și a forma ioni cu o sarcină pozitivă de +1. Această reactivitate ridicată se datorează configurației lor electronice externe, care este ns1.
Metalele alcaline sunt moi, cu densitate scăzută și puncte de topire și fierbere scăzute. Ele reacționează violent cu apa, producând hidrogen gazos și o soluție alcalină. De asemenea, reacționează cu oxigenul pentru a forma oxizi, cu halogenii pentru a forma halogenuri și cu sulfura pentru a forma sulfuri. Reactivitatea lor crește pe măsură ce coborâm în grup, datorită creșterii razei atomice și scăderii energiei de ionizare.
Metalele alcaline sunt esențiale pentru viața umană și joacă roluri importante în diverse procese biologice. De exemplu, sodiul și potasiul sunt esențiale pentru conducerea impulsurilor nervoase și contracția musculară.
Metalele alcalino-pământoase
Metalele alcalino-pământoase sunt elementele din grupa a doua a tabelului periodic (grupa 2), cu excepția beriliului, care prezintă proprietăți mai asemănătoare cu cele ale aluminiului. Aceste metale sunt mai puțin reactive decât metalele alcaline, dar sunt totuși foarte reactive, având doi electroni în stratul de valență. Această configurație electronică externă, ns2, le conferă o tendință de a pierde acești doi electroni și de a forma ioni cu o sarcină pozitivă de +2.
Metalele alcalino-pământoase sunt mai dure, cu densitate mai mare și puncte de topire și fierbere mai ridicate decât metalele alcaline. Ele reacționează cu apa, dar mai lent decât metalele alcaline, producând hidrogen gazos și o soluție alcalină. De asemenea, reacționează cu oxigenul pentru a forma oxizi, cu halogenii pentru a forma halogenuri și cu sulfura pentru a forma sulfuri. Reactivitatea lor crește pe măsură ce coborâm în grup, datorită creșterii razei atomice și scăderii energiei de ionizare.
Metalele alcalino-pământoase sunt prezente în diverse minerale și roci. Calciul este un element esențial pentru formarea oaselor și dinților, iar magneziul este important pentru fotosinteză și funcția musculară.
Halogenii
Halogenii sunt elementele din grupa a șaptesprezecea a tabelului periodic (grupa 17), care include fluorul (F), clorul (Cl), bromul (Br), iodul (I) și astatul (At). Aceste elemente sunt nemetale foarte reactive, cu o configurație electronică externă de ns2np5. Această configurație le permite să câștige un electron pentru a forma ioni negativi cu o sarcină de -1, completând astfel octetul de electroni.
Halogenii sunt substanțe puternic electronegative și au o tendință mare de a forma legături ionice cu metalele. De asemenea, pot forma legături covalente între ele, formând molecule diatomice (F2, Cl2, Br2, I2). Reactivitatea halogenilor scade pe măsură ce coborâm în grup, datorită creșterii razei atomice și scăderii electronegativității.
Halogenii au o gamă largă de aplicații. Fluorul este utilizat în pasta de dinți pentru a preveni cariile dentare, clorul este folosit pentru a dezinfecta apa potabilă, iar bromul este folosit în fabricarea unor medicamente și substanțe chimice. Iodul este esențial pentru funcția tiroidiană și este prezent în sare iodată.
Gazoase nobile
Gazoasele nobile, cunoscute și ca gaze inerte, sunt elementele din grupa a optsprezecea a tabelului periodic (grupa 18). Acestea includ heliu (He), neon (Ne), argon (Ar), kripton (Kr), xenon (Xe) și radon (Rn). Gazoasele nobile sunt caracterizate printr-o configurație electronică externă completă, ns2np6, cu excepția heliului, care are o configurație electronică de 1s2. Această configurație stabilă le conferă o reactivitate extrem de scăzută, motiv pentru care au fost denumite inițial “gaze inerte”.
Gazoasele nobile sunt gaze monoatomice la temperatura camerei și au puncte de fierbere foarte scăzute. Ele sunt practic incolore, inodore și insipid. Gazoasele nobile sunt prezente în atmosferă în cantități mici, iar heliu este al doilea element ca abundență în univers.
Deși au fost considerate mult timp inerte, s-a descoperit că unele gaze nobile pot forma compuși cu alte elemente, în special cu fluorul. Aceste descoperiri au condus la o reconsiderare a definiției gazelor nobile și au deschis noi căi de cercetare în chimie.
Metalele de tranziție
Metalele de tranziție sunt elementele chimice situate în grupele 3-12 din tabelul periodic. Acestea sunt caracterizate printr-o configurație electronică specifică, cu electroni în orbitalii d incomplet. Această configurație electronică conferă metalelor de tranziție o serie de proprietăți unice, inclusiv conductivitate electrică și termică ridicată, puncte de topire și fierbere ridicate, precum și o tendință de a forma ioni cu mai multe stări de oxidare.
Metalele de tranziție sunt cunoscute pentru proprietățile lor magnetice, unele fiind feromagnetice (fier, cobalt, nichel), paramagnetice sau diamagnetice. De asemenea, ele sunt utilizate pe scară largă în industrie, în diverse aplicații, de la construcții și fabricarea de aliaje metalice la cataliză și electronică.
Exemple de metale de tranziție includ fierul (Fe), cuprul (Cu), aurul (Au), argintul (Ag) și platina (Pt). Metalele de tranziție sunt esențiale pentru viața umană, fiind implicate în diverse procese biologice, cum ar fi transportul de oxigen în sânge (fierul) și funcționarea enzimelor (cuprul, zincul).
Lantanidele
Lantanidele, cunoscute și sub numele de elemente de pământuri rare, sunt un grup de 15 elemente chimice cu numerele atomice de la 57 (lantan) la 71 (lutețiu). Acestea sunt situate în perioada a 6-a a tabelului periodic, sub scandiu și ytriu, și sunt de obicei grupate separat de restul tabelului periodic, de obicei sub forma unui rând separat.
Lantanidele au configurații electronice similare, cu electronii de valență în orbitalii 4f. Această configurație electronică conduce la proprietăți chimice similare, inclusiv o tendință de a forma ioni trivalenți (M3+).
Lantanidele sunt metale moi, reactive, cu puncte de topire și fierbere relativ ridicate. Ele sunt utilizate în diverse aplicații, de la fabricarea de magneți puternici (neodim, praseodim) și a catalizatorilor (ceriu) la iluminat (europiu) și lasere (erbiu). Deși sunt denumite “pământuri rare”, lantanidele nu sunt atât de rare în scoarța terestră, dar sunt dispersate în minerale complexe, ceea ce face dificilă extracția lor.
Textul este bine structurat și ușor de citit. Informațiile sunt prezentate într-o manieră logică și coerentă. Articolul ar putea beneficia de adăugarea unor imagini sau diagrame pentru a ilustra mai bine conceptele prezentate.
Articolul este o resursă utilă pentru cei care doresc să învețe despre tabelul periodic. Apreciez modul în care sunt prezentate informațiile, dar aș sugera adăugarea unor informații despre aplicațiile practice ale tabelului periodic în diverse domenii.
Articolul este bine scris și ușor de înțeles. Apreciez modul în care sunt prezentate informațiile, dar aș sugera adăugarea unor referințe bibliografice pentru a sprijini afirmațiile făcute.
Articolul prezintă o introducere clară și concisă în conceptul elementelor chimice și al tabelului periodic. Explicația este ușor de înțeles, chiar și pentru cei care nu au o pregătire științifică avansată. Exemplele folosite sunt relevante și ajută la ilustrarea conceptelor prezentate.
Articolul este o resursă utilă pentru cei care doresc să învețe despre tabelul periodic. Apreciez modul în care sunt prezentate informațiile, dar aș sugera adăugarea unor secțiuni separate despre diferitele grupe și perioade din tabelul periodic.
Articolul este clar și concis, dar ar putea fi îmbunătățit prin adăugarea unor informații despre legăturile chimice și despre modul în care atomii se combină pentru a forma molecule.
Articolul este o introducere bună în tabelul periodic, dar ar putea fi îmbunătățit prin adăugarea unor informații despre aplicațiile practice ale tabelului periodic în diverse domenii, cum ar fi medicina, industria și agricultura.
Articolul este bine scris și informativ, oferind o imagine de ansamblu a elementelor chimice și a tabelului periodic. Aș sugera adăugarea unor informații despre tendințele periodice, cum ar fi electronegativitatea și energia de ionizare.
Articolul este informativ și util, oferind o introducere solidă în tabelul periodic. Apreciez modul în care sunt prezentate proprietățile chimice și fizice ale elementelor, precum și importanța tabelului periodic în chimie.
Articolul este o introducere bună în tabelul periodic, dar ar putea fi îmbunătățit prin adăugarea unor informații despre istoria tabelului periodic și despre contribuția lui Dmitri Mendeleev la dezvoltarea sa.
Textul este clar și concis, dar ar putea fi îmbunătățit prin adăugarea unor detalii suplimentare despre istoria tabelului periodic și despre contribuția lui Dmitri Mendeleev la dezvoltarea sa.
Articolul este o introducere excelentă în tabelul periodic, dar ar putea fi îmbunătățit prin adăugarea unor informații despre izotopi și radioactivitatea elementelor.