Elemente interesante din tabelul periodic
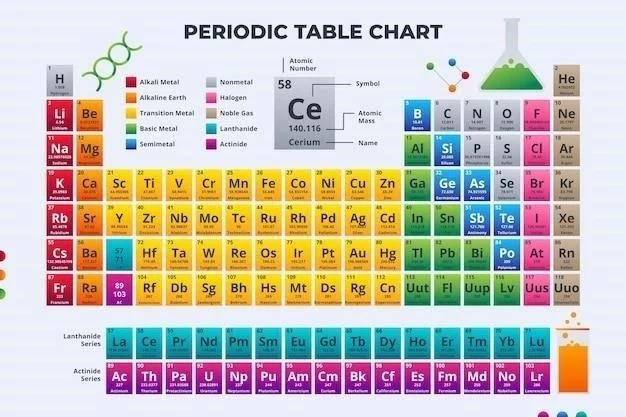

Elemente interesante din tabelul periodic
Tabelul periodic al elementelor este o hartă a universului chimic, ce prezintă o colecție fascinantă de elemente cu proprietăți unice. De la metalele strălucitoare la gazele incolore, fiecare element are o poveste de spus, o contribuție la diversitatea lumii noastre.
Introducere
Tabelul periodic al elementelor este o reprezentare vizuală a tuturor elementelor chimice cunoscute, organizate în funcție de numărul atomic crescător și proprietățile chimice similare. Această hartă a universului chimic ne oferă o imagine de ansamblu asupra diversității și complexității materiei, dezvăluind o lume fascinantă de elemente cu proprietăți unice și aplicații diverse. De la elementele esențiale pentru viață, precum carbonul și oxigenul, la elementele rare și radioactive, fiecare element are o poveste de spus, o contribuție la diversitatea lumii noastre.
Explorarea tabelului periodic este o călătorie captivantă prin lumea chimiei, dezvăluind elemente cu proprietăți neașteptate, de la metale cu puncte de topire incredibil de joase, precum mercurul, la elemente cu o reactivitate extrem de ridicată, precum cesiul.
Proprietățile elementelor
Fiecare element din tabelul periodic este definit de un set unic de proprietăți chimice și fizice, care determină comportamentul său în reacțiile chimice și în diverse aplicații. Aceste proprietăți sunt strâns legate de structura atomului elementului respectiv, mai precis de numărul de protoni, neutroni și electroni din nucleul și învelișul electronic al atomului.
Numărul atomic (Z) reprezintă numărul de protoni din nucleul unui atom, definind identitatea elementului. Masa atomică (A) este suma numărului de protoni și neutroni din nucleu, reflectând masa atomului. Configurația electronică a unui element descrie modul în care electronii sunt aranjați în jurul nucleului, determinând proprietățile chimice ale elementului.
Numărul atomic și masa atomică
Numărul atomic (Z) este o proprietate fundamentală a unui element, reprezentând numărul de protoni din nucleul atomului. Această valoare este unică pentru fiecare element și determină identitatea sa chimică. De exemplu, hidrogenul (H) are un număr atomic de 1, ceea ce înseamnă că fiecare atom de hidrogen are un singur proton.
Masa atomică (A) este o măsură a masei unui atom, exprimată în unități de masă atomică (u.a.m.). Masa atomică este determinată de suma numărului de protoni și neutroni din nucleul atomului. De exemplu, carbonul (C) are o masă atomică de 12 u.a.m., deoarece nucleul său conține 6 protoni și 6 neutroni.
Configurația electronică
Configurația electronică a unui element descrie modul în care electronii sunt aranjați în jurul nucleului atomului. Această aranjare influențează puternic proprietățile chimice ale elementului. Electronii sunt distribuiți în diverse nivele de energie, fiecare nivel fiind împărțit în subnivele.
De exemplu, configurația electronică a oxigenului (O) este $1s^22s^22p^4$. Aceasta înseamnă că oxigenul are doi electroni în nivelul de energie 1, doi electroni în nivelul de energie 2 și patru electroni în subnivelul 2p. Această configurație explică de ce oxigenul este un element reactiv, căutând să obțină doi electroni pentru a completa subnivelul 2p și a atinge stabilitatea.
Reactivitatea
Reactivitatea unui element se referă la tendința sa de a participa la reacții chimice. Această tendință este influențată de configurația electronică, mai precis de numărul de electroni de valență, acei electroni care se află în ultimul nivel de energie. Elementele cu un număr mic de electroni de valență, cum ar fi metalele alcaline, sunt foarte reactive, căutând să cedeze acești electroni pentru a atinge o configurație electronică stabilă.
Pe de altă parte, elementele cu un număr mare de electroni de valență, cum ar fi halogenii, sunt de asemenea reactive, căutând să câștige electroni pentru a completa ultimul nivel de energie. Elementele cu configurații electronice stabile, cum ar fi gazele nobile, sunt foarte puțin reactive, deoarece au o configurație electronică completă.
Metale, nemetale și metaloide
Elementele din tabelul periodic pot fi clasificate în trei categorii principale⁚ metale, nemetale și metaloide. Această clasificare se bazează pe proprietățile lor fizice și chimice, cum ar fi conductivitatea electrică și termică, luciul, maleabilitatea și ductilitatea. Metalele, care reprezintă majoritatea elementelor din tabelul periodic, sunt în general solide, lucioase, bune conducătoare de căldură și electricitate, maleabile și ductile.
Nemetalele, situate în partea dreaptă a tabelului periodic, sunt în general solide, lichide sau gaze, cu proprietăți variate. Ele sunt slabe conducătoare de căldură și electricitate, fragile și nu sunt maleabile sau ductile. Metaloidele, situate între metale și nemetale, prezintă proprietăți intermediare, având o conductivitate electrică variabilă și o reactivitate dependentă de condițiile de reacție.
Metale
Metalele, cu proprietățile lor caracteristice, joacă un rol crucial în viața noastră de zi cu zi. De la fierul din structurile de oțel la cuprul din cablurile electrice, metalele ne înconjoară, contribuind la progresul tehnologic și la confortul cotidian. Ele sunt cunoscute pentru luciul lor caracteristic, conductivitatea electrică și termică excelentă, precum și pentru maleabilitatea și ductilitatea lor, care le permit să fie modelate în diverse forme.
În funcție de reactivitate, metalele pot fi clasificate în metale alcaline, metale alcalino-pământoase, metale de tranziție și metale post-tranziție. Fiecare grup prezintă proprietăți specifice, influențate de configurația electronică a atomilor lor. Interacțiunile dintre atomii metalici, prin intermediul legăturilor metalice, explică proprietățile fizice și chimice unice ale metalelor.
Nemetale
Nemetalele, în contrast cu metalele, prezintă o diversitate de proprietăți fizice și chimice. De la gazele incolore și inodore, precum azotul și oxigenul, la solidele fragile, precum fosforul și sulful, nemetalele joacă un rol esențial în diverse procese biologice și industriale.
Ele sunt caracterizate prin lipsa luciului metalic, conductivitate electrică scăzută și puncte de topire și fierbere relativ scăzute. Nemetalele au tendința de a forma legături covalente, împărțind electroni cu alți atomi, rezultând în molecule cu diverse forme și proprietăți. De exemplu, oxigenul, esențial pentru respirație, formează molecule diatomice ($O_2$), în timp ce carbonul, baza vieții, poate forma lanțuri lungi și complexe, ca în cazul hidrocarburilor.
Metaloide
Metaloidele, cunoscute și ca semimetale, se află la granița dintre metale și nemetale în tabelul periodic, posedând proprietăți intermediare. Ele prezintă o conductivitate electrică variabilă, de la conductoare slabe la semiconductori, ceea ce le face esențiale în industria electronică. De exemplu, siliciul, cel mai abundent metaloid, este folosit în fabricarea cipurilor de calculator și a panourilor solare.
Metaloidele pot prezenta atât caracteristici metalice, precum luciul, cât și nemetalice, precum fragilitatea. Ele pot forma aliaje cu metalele, influențând proprietățile lor fizice și chimice. De exemplu, germaniu, un alt metaloid important, este utilizat în fabricarea tranzistorilor și a altor dispozitive electronice. Metaloidele, cu natura lor hibridă, demonstrează diversitatea și complexitatea lumii elementelor.
Elemente neobișnuite și rare
Tabelul periodic găzduiește o colecție de elemente neobișnuite și rare, care captează imaginația prin proprietățile lor unice. Aceste elemente, deși prezente în cantități mici în natură, joacă roluri esențiale în diverse domenii, de la tehnologie la medicină. De exemplu, aurul, un metal prețios și inert, este utilizat în bijuterii, electronică și medicină datorită proprietăților sale antibacteriene.
Un alt element neobișnuit este platina, un metal dens și rezistent la coroziune, utilizat în cataliză, bijuterii și instrumente chirurgicale. Elementele rare, precum lantanul și neodimul, sunt esențiale în fabricarea laserelor, a magneților permanenți și a altor tehnologii avansate. Aceste elemente, deși rare, demonstrează diversitatea și complexitatea lumii elementelor, contribuind la progresul științific și tehnologic.
Gaze nobile
Gaze nobile, cunoscute și ca gaze inerte, formează un grup unic de elemente din grupa 18 a tabelului periodic. Aceste elemente, inclusiv heliu (He), neon (Ne), argon (Ar), kripton (Kr), xenon (Xe) și radon (Rn), sunt caracterizate prin stabilitate chimică remarcabilă, datorită configurației lor electronice complete. Ele se găsesc în atmosferă în cantități mici și sunt utilizate în diverse aplicații.
Heliul, cel mai ușor dintre gazele nobile, este utilizat în baloane, în criogenie și în imagistica medicală prin rezonanță magnetică (RMN). Neonul este utilizat în tuburi luminescente, oferind o lumină roșie caracteristică. Argonul, cel mai abundent gaz nobil, este utilizat în lămpi fluorescente, în sudură și în producția de semiconductori. Aceste gaze nobile, deși inerte, au găsit aplicații diverse, demonstrând utilitatea lor în diverse domenii.
Halogeni
Halogenii, grupa 17 a tabelului periodic, sunt o familie de elemente nemetalice foarte reactive. Această familie include fluorul (F), clorul (Cl), bromul (Br), iodul (I) și astatul (At), toate având 7 electroni de valență. Această configurație electronică le conferă o afinitate puternică pentru a câștiga un electron, formând anioni cu o sarcină negativă (-1), cunoscuți ca halogenuri.
Halogenii sunt esențiali pentru viața umană, fluorul fiind utilizat în pasta de dinți pentru a preveni cariile dentare, iar clorul în tratarea apei potabile. Bromul este utilizat în diverse aplicații industriale, inclusiv în producția de pesticide și a medicamentelor. Iodul este esențial pentru funcționarea corectă a glandei tiroide. Aceste elemente, deși reactive, sunt esențiale pentru diverse procese naturale și industriale.
Metale alcaline
Metalele alcaline, grupa 1 a tabelului periodic, sunt o familie de elemente reactive, moi și lucioase, cu un singur electron de valență. Această configurație electronică le conferă o reactivitate ridicată, reacționând violent cu apa, eliberând hidrogen și formând hidroxizi alcalini. Aceste elemente sunt atât de reactive încât se găsesc în natură doar sub formă de compuși.
Litiul (Li) este utilizat în bateriile din telefoane mobile și laptopuri, datorită densității sale scăzute și a capacității sale de a stoca energie. Sodiul (Na) este un element esențial pentru funcționarea organismului uman, fiind implicat în transmiterea impulsurilor nervoase și în menținerea echilibrului fluidelor. Potasiul (K) este de asemenea esențial pentru sănătate, fiind implicat în contracția musculară și în reglarea tensiunii arteriale. Metalele alcaline, deși reactive, joacă un rol important în diverse domenii, de la tehnologie la biologie.
Metale alcalino-pământoase
Metalele alcalino-pământoase, grupa 2 a tabelului periodic, sunt elemente reactive, dar mai puțin reactive decât metalele alcaline. Acestea au două electroni de valență, ceea ce le conferă o reactivitate mai scăzută, dar totuși suficientă pentru a reacționa cu apa și a forma hidroxizi.
Beriliul (Be) este un metal ușor și rezistent, utilizat în diverse aliaje pentru a le îmbunătăți proprietățile mecanice. Magneziul (Mg) este un element esențial pentru plante și animale, fiind implicat în fotosinteză și în contracția musculară. Calciul (Ca) este un element abundent în scoarța terestră și este esențial pentru formarea oaselor și dinților.
Metalele alcalino-pământoase sunt elemente esențiale pentru diverse procese biologice și au aplicații industriale importante, de la fabricarea aliajelor la agricultura.
Metale de tranziție
Metalele de tranziție, situate în grupele 3-12 ale tabelului periodic, sunt elemente cu proprietăți unice, caracterizate de o varietate de stări de oxidare și de o tendință de a forma compuși colorați. Această diversitate se datorează configurației lor electronice, cu electroni de valență în orbitalii d, ceea ce le conferă o flexibilitate în formarea legăturilor chimice.
Fierul (Fe), cuprul (Cu) și aurul (Au) sunt exemple clasice de metale de tranziție cu aplicații vaste în diverse domenii, de la construcții și industrie la bijuterii și electronică. Elementele din grupa platinei, precum platina (Pt) și paladiul (Pd), sunt cunoscute pentru proprietățile lor catalitice și rezistența la coroziune, fiind utilizate în cataliză și în bijuterii.
Metalele de tranziție contribuie la diversitatea lumii materiale, având un rol esențial în tehnologie, medicină și artă.
Lantanide și actinide
Lantanidele și actinidele, cunoscute și ca metale rare de pământ, ocupă poziții speciale în tabelul periodic, aflate în perioada a 6-a și a 7-a, respectiv. Aceste elemente prezintă proprietăți chimice similare, datorită configurației electronice asemănătoare, cu electroni de valență în orbitalii f.
Lantanidele, de la lantan (La) la lutețiu (Lu), sunt utilizate în diverse aplicații, de la fabricarea de magneți permanenți la iluminat fluorescent. Actinidele, de la actiniu (Ac) la lawrențiu (Lr), sunt elemente radioactive, cu o importanță semnificativă în domeniul energiei nucleare. Uraniul (U) este combustibil nuclear, iar plutoniul (Pu) este utilizat în arme nucleare.
Deși rare, lantanidele și actinidele joacă un rol crucial în diverse domenii, de la tehnologie la medicină.
Elemente radioactive
Elementele radioactive sunt acele elemente care au nuclei instabili, suferind dezintegrări radioactive, emițând radiații ionizante. Aceste radiații pot fi alfa (particule de heliu), beta (electroni sau pozitroni) sau gamma (radiații electromagnetice).
Radioactivitatea este un fenomen natural, cu aplicații importante în diverse domenii. De exemplu, izotopii radioactivi sunt utilizați în medicina nucleară pentru diagnosticarea și tratarea bolilor, în arheologie pentru datarea artefactelor, iar în industria nucleară pentru producerea energiei electrice.
Totuși, radiațiile ionizante pot fi dăunătoare pentru sănătate, iar manipularea elementelor radioactive necesită precauții speciale pentru a preveni expunerea excesivă.
Concluzie
Tabelul periodic al elementelor este o resursă esențială pentru înțelegerea lumii din jurul nostru. Fiecare element, de la hidrogenul ușor la uraniul greu, are un rol unic în universul chimic. De la metalele strălucitoare și reactive, la gazele nobile inerte, fiecare element prezintă o poveste fascinantă, o contribuție la diversitatea și complexitatea lumii noastre.
Studiul elementelor ne permite să înțelegem mai bine legile naturii, să dezvoltăm tehnologii noi și să găsim soluții pentru problemele cu care ne confruntăm. Descoperirea de noi elemente sau proprietăți neașteptate ale elementelor cunoscute continuă să ne inspire și să ne motiveze în explorarea lumii fascinante a chimiei.
Articolul abordează o temă complexă într-un mod accesibil și captivant. Explicarea proprietăților elementelor, inclusiv a numărului atomic și a masei atomice, este clară și concisă. Recomand cu căldură acest articol tuturor celor interesați de chimie.
Articolul prezintă o introducere clară și concisă în lumea fascinantă a tabelului periodic. Explicațiile oferite sunt ușor de înțeles, chiar și pentru cei care nu au o pregătire avansată în chimie. Apreciez modul în care autorul subliniază importanța tabelului periodic ca instrument de organizare și înțelegere a elementelor chimice.
Articolul este bine structurat și ușor de citit. Explicațiile sunt clare și concise, iar exemplele folosite sunt relevante și ușor de înțeles. Recomand cu căldură acest articol tuturor celor interesați de chimie.
Articolul prezintă o perspectivă interesantă asupra tabelului periodic, evidențiind diversitatea și complexitatea elementelor chimice. Apreciez modul în care autorul subliniază importanța tabelului periodic în diverse domenii, de la medicină la tehnologie.
Articolul este captivant și informativ, prezentând o imagine de ansamblu asupra tabelului periodic și a elementelor chimice. Apreciez modul în care autorul subliniază importanța tabelului periodic în diverse domenii, de la medicină la tehnologie.
Articolul prezintă o introducere excelentă în tabelul periodic, evidențiind importanța sa în înțelegerea lumii chimice. Apreciez modul în care autorul subliniază diversitatea și complexitatea elementelor chimice, precum și aplicațiile lor diverse.
Articolul este bine documentat și oferă o perspectivă clară asupra tabelului periodic. Apreciez modul în care autorul explică proprietățile elementelor, inclusiv numărul atomic și masa atomică, într-un mod ușor de înțeles.