Elementele diatomice
Ce sunt elementele diatomice?
Elementele diatomice sunt elemente chimice care există în mod natural ca molecule formate din doi atomi ai aceluiași element.
Introducere
În lumea chimiei, atomii sunt blocurile de construcție ale materiei. Acești atomi se pot combina între ei pentru a forma molecule, unități mai complexe care posedă proprietăți unice. Printre diversele tipuri de molecule, există o categorie specială numită molecule diatomice, care constau din doi atomi legați covalent. Aceste molecule diatomice pot fi formate din același element (homonucleare) sau din elemente diferite (heteronucleare).
Elementele diatomice homonucleare sunt particulare deoarece ele există în mod natural ca molecule cu doi atomi ai aceluiași element. Aceste elemente sunt esențiale pentru viața pe Pământ, jucând roluri importante în procesele biologice, chimice și fizice. Înțelegerea naturii și proprietăților elementelor diatomice este crucială pentru a aprofunda cunoștințele noastre despre lumea din jurul nostru.
În această lucrare, vom explora în detaliu cele 7 elemente diatomice, examinând caracteristicile lor unice, proprietățile lor chimice și fizice, precum și importanța lor în diverse domenii.
Definiția elementelor diatomice
Elementele diatomice sunt elemente chimice care există în mod natural ca molecule formate din doi atomi ai aceluiași element. Aceste molecule sunt stabilizate prin formarea de legături covalente, unde doi atomi împart electroni pentru a atinge o configurație electronică mai stabilă. Legătura covalentă este o forță puternică care menține cei doi atomi împreună, formând o unitate distinctă.
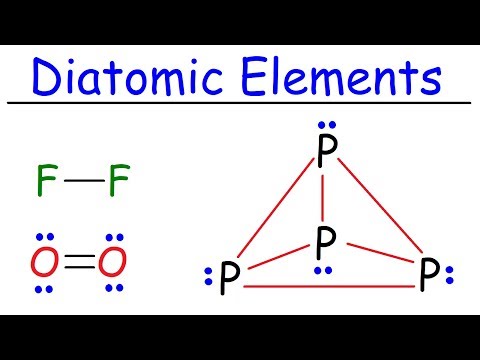
Deși există multe elemente chimice în tabelul periodic, doar șapte dintre ele apar în mod natural ca molecule diatomice în condiții standard de temperatură și presiune. Aceste elemente sunt hidrogenul ($H_2$), azotul ($N_2$), oxigenul ($O_2$), fluorul ($F_2$), clorul ($Cl_2$), bromul ($Br_2$) și iodul ($I_2$). Astatina ($At_2$) este, de asemenea, considerată un element diatomic, dar este radioactiv și extrem de rar, cu o durată de viață scurtă.
Elementele diatomice homonucleare sunt esențiale pentru viața pe Pământ, jucând roluri importante în diverse procese biologice, chimice și fizice. De exemplu, oxigenul este esențial pentru respirația organismelor vii, azotul este un component major al atmosferei și hidrogenul este un element crucial în reacțiile chimice.
Tipuri de molecule diatomice
Moleculele diatomice pot fi clasificate în două categorii principale, în funcție de tipul de atomi care le compun⁚
Molecule homonucleare
Moleculele homonucleare sunt formate din doi atomi ai aceluiași element. De exemplu, moleculele de hidrogen ($H_2$), azot ($N_2$), oxigen ($O_2$) și clor ($Cl_2$) sunt toate molecule homonucleare. Aceste molecule sunt de obicei foarte stabile, deoarece legătura covalentă dintre cei doi atomi identici este puternică și echilibrată.
Molecule heteronucleare
Moleculele heteronucleare sunt formate din doi atomi ai unor elemente diferite. De exemplu, monoxidul de carbon ($CO$) și clorura de hidrogen ($HCl$) sunt molecule heteronucleare. Aceste molecule pot fi la fel de stabile ca și moleculele homonucleare, dar legătura covalentă dintre atomii diferiți poate fi mai polară, ceea ce poate afecta proprietățile moleculei.
Indiferent de tipul lor, moleculele diatomice joacă roluri importante în diverse domenii, de la chimie și fizică la biologie și tehnologie.
Molecule homonucleare
Moleculele homonucleare sunt formate din doi atomi ai aceluiași element chimic. Aceste molecule sunt caracterizate printr-o legătură covalentă puternică și echilibrată între cei doi atomi identici. Exemple de molecule homonucleare includ⁚
- Hidrogenul ($H_2$)⁚ Cea mai simplă moleculă diatomică, formată din doi atomi de hidrogen legați printr-o legătură covalentă simplă. Hidrogenul este un gaz incolor, inodor și foarte inflamabil, care este utilizat pe scară largă în diverse industrii, inclusiv în sinteza amoniacului și a combustibililor.
- Azotul ($N_2$)⁚ Un gaz incolor, inodor și inert, care constituie aproximativ 78% din atmosfera terestră. Azotul este esențial pentru viața plantelor și animalelor, fiind un component al proteinelor și acizilor nucleici.
- Oxigenul ($O_2$)⁚ Un gaz incolor, inodor și esențial pentru respirația organismelor vii. Oxigenul este utilizat pe scară largă în diverse industrii, inclusiv în producția de oțel și în industria chimică.
- Fluorul ($F_2$)⁚ Un gaz galben-verzui, foarte reactiv și toxic. Fluorul este utilizat în diverse aplicații, inclusiv în producția de Teflon și în stomatologie.
- Clorul ($Cl_2$)⁚ Un gaz galben-verzui, cu un miros înțepător și toxic. Clorul este utilizat în diverse aplicații, inclusiv în tratarea apei potabile și în producția de substanțe chimice.
- Bromul ($Br_2$)⁚ Un lichid brun-roșcat, volatil și coroziv. Bromul este utilizat în diverse aplicații, inclusiv în producția de pesticide și în industria farmaceutică.
- Iodul ($I_2$)⁚ Un solid negru-violet, volatil și sublimabil. Iodul este esențial pentru funcționarea glandei tiroide și este utilizat în diverse aplicații, inclusiv în dezinfecție și în industria farmaceutică.
Aceste molecule homonucleare joacă roluri importante în diverse domenii, de la chimie și fizică la biologie și tehnologie.
Molecule heteronucleare
Moleculele heteronucleare sunt formate din doi atomi de elemente chimice diferite. Aceste molecule sunt caracterizate printr-o legătură covalentă polară, unde electronii sunt distribuiți inegal între cei doi atomi. Această distribuție inegală a electronilor creează un moment dipolar, ceea ce face ca moleculele heteronucleare să fie polare.
Exemple de molecule heteronucleare includ⁚
- Monoxidul de carbon ($CO$)⁚ Un gaz incolor, inodor și toxic, care este un constituent major al gazului de sinteză. Monoxidul de carbon este utilizat în diverse aplicații, inclusiv în producția de metanol și în industria chimică.
- Oxidul de azot ($NO$)⁚ Un gaz incolor, cu un miros înțepător și toxic, care este un constituent major al smogului urban. Oxidul de azot este utilizat în diverse aplicații, inclusiv în producția de acid nitric și în industria farmaceutică.
- Clorura de hidrogen ($HCl$)⁚ Un gaz incolor, cu un miros înțepător și toxic, care este utilizat în diverse aplicații, inclusiv în producția de acid clorhidric și în industria farmaceutică.
- Bromura de hidrogen ($HBr$)⁚ Un gaz incolor, cu un miros înțepător și toxic, care este utilizat în diverse aplicații, inclusiv în producția de acid bromhidric și în industria farmaceutică.
- Iodura de hidrogen ($HI$)⁚ Un gaz incolor, cu un miros înțepător și toxic, care este utilizat în diverse aplicații, inclusiv în producția de acid iodhidric și în industria farmaceutică.
Aceste molecule heteronucleare joacă roluri importante în diverse domenii, de la chimie și fizică la biologie și tehnologie.
Cele 7 elemente diatomice
Cele șapte elemente diatomice sunt⁚ hidrogenul ($H_2$), azotul ($N_2$), oxigenul ($O_2$), fluorul ($F_2$), clorul ($Cl_2$), bromul ($Br_2$) și iodul ($I_2$).
Hidrogenul ($H_2$)
Hidrogenul este cel mai ușor element din tabelul periodic, cu un număr atomic de 1. În condiții standard de temperatură și presiune, hidrogenul există ca un gaz diatomic, $H_2$. Molecula de hidrogen este formată din doi atomi de hidrogen legați covalent printr-o legătură simplă. Legătura covalentă este o legătură chimică care se formează atunci când doi atomi împart electroni.
Hidrogenul este un element foarte reactiv și poate forma compuși cu o gamă largă de alte elemente. Este, de asemenea, un element esențial pentru viață, fiind un component al apei și al multor molecule organice. Hidrogenul este utilizat în diverse aplicații, cum ar fi producerea de amoniac, combustibil, și ca agent reducător în diverse procese chimice.
Hidrogenul este un gaz incolor, inodor și inflamabil. Punctul său de fierbere este de -252,87 °C, iar punctul său de topire este de -259,14 °C. Hidrogenul este unul dintre cele mai abundente elemente din univers, reprezentând aproximativ 75% din masa totală a universului.
Azotul ($N_2$)
Azotul este un element chimic cu simbolul N și numărul atomic 7. În condiții standard de temperatură și presiune, azotul există ca un gaz diatomic, $N_2$. Molecula de azot este formată din doi atomi de azot legați covalent printr-o legătură triplă. Legătura triplă este o legătură chimică foarte puternică, ceea ce explică stabilitatea ridicată a moleculei de azot.
Azotul este un element esențial pentru viață, fiind un component al proteinelor, ADN-ului și ARN-ului. Azotul este, de asemenea, un element important în agricultură, fiind un nutrient esențial pentru creșterea plantelor. Azotul este utilizat în diverse aplicații, cum ar fi producerea de îngrășăminte, explozivi și ca gaz inert în diverse procese industriale.
Azotul este un gaz incolor, inodor și insipid. Punctul său de fierbere este de -195,79 °C, iar punctul său de topire este de -210,01 °C. Azotul este cel mai abundent gaz din atmosfera Pământului, reprezentând aproximativ 78% din volumul total al atmosferei;
Oxigenul ($O_2$)
Oxigenul este un element chimic cu simbolul O și numărul atomic 8. Este un element chimic foarte reactiv și se găsește în mod natural ca un gaz diatomic, $O_2$; Molecula de oxigen este formată din doi atomi de oxigen legați covalent printr-o legătură dublă. Legătura dublă este o legătură chimică puternică, ceea ce explică stabilitatea ridicată a moleculei de oxigen.
Oxigenul este esențial pentru viață, fiind implicat în procesul de respirație celulară, care produce energie pentru toate organismele vii. Oxigenul este, de asemenea, un element important în arderea combustibililor, proces care produce energie și căldură; Oxigenul este utilizat în diverse aplicații, cum ar fi producerea de oțel, fabricarea de medicamente și ca gaz inert în diverse procese industriale.
Oxigenul este un gaz incolor, inodor și insipid. Punctul său de fierbere este de -183 °C, iar punctul său de topire este de -218,8 °C. Oxigenul este al doilea cel mai abundent gaz din atmosfera Pământului, reprezentând aproximativ 21% din volumul total al atmosferei.
Fluorul ($F_2$)
Fluorul este un element chimic cu simbolul F și numărul atomic 9. Este un element chimic foarte reactiv, fiind cel mai electronegativ element din tabelul periodic. Fluorul se găsește în mod natural ca un gaz diatomic, $F_2$. Molecula de fluor este formată din doi atomi de fluor legați covalent printr-o legătură simplă. Legătura simplă este o legătură chimică puternică, ceea ce explică stabilitatea ridicată a moleculei de fluor.
Fluorul este un element chimic foarte reactiv și este utilizat în diverse aplicații industriale. Este utilizat în producția de teflon, un material plastic rezistent la căldură și la substanțe chimice. Fluorul este, de asemenea, utilizat în producția de freon, un agent frigorific utilizat în diverse aplicații industriale. Fluorul este un element chimic important în industria farmaceutică, fiind utilizat în sinteza unor medicamente.
Fluorul este un gaz galben pal, cu un miros puternic și iritant. Punctul său de fierbere este de -188,1 °C, iar punctul său de topire este de -219,6 °C. Fluorul este un element chimic foarte reactiv și este utilizat cu precauție în laboratoarele chimice.
Clorul ($Cl_2$)
Clorul este un element chimic cu simbolul Cl și numărul atomic 17. Este un halogen găsit în mod natural ca un gaz diatomic, $Cl_2$. Molecula de clor este formată din doi atomi de clor legați covalent printr-o legătură simplă. Legătura simplă este o legătură chimică puternică, ceea ce explică stabilitatea ridicată a moleculei de clor. Clorul este un element chimic foarte reactiv și este utilizat în diverse aplicații industriale.
Clorul este utilizat în principal în producția de clorură de sodiu (sare de masă), un compus chimic esențial pentru viața umană. De asemenea, clorul este utilizat în producția de clorură de vinil, un material plastic utilizat în producția de tuburi, țevi și alte produse din plastic. Clorul este utilizat și în producția de clorură de polivinil (PVC), un material plastic utilizat în diverse aplicații, inclusiv în construcții și în industria auto.
Clorul este un gaz galben-verzui, cu un miros înțepător și iritant. Punctul său de fierbere este de -34,0 °C, iar punctul său de topire este de -101,5 °C. Clorul este un element chimic foarte reactiv și este utilizat cu precauție în laboratoarele chimice;
Bromul ($Br_2$)
Bromul este un element chimic cu simbolul Br și numărul atomic 35. Este un halogen găsit în mod natural ca un lichid diatomic, $Br_2$. Molecula de brom este formată din doi atomi de brom legați covalent printr-o legătură simplă. Bromul este un element chimic relativ reactiv, dar mai puțin reactiv decât clorul. Bromul este utilizat în diverse aplicații industriale, inclusiv în producția de pesticide, ignifuganti și medicamente.
Bromul este un lichid roșu-brun, cu un miros înțepător și iritant. Punctul său de fierbere este de 58,8 °C, iar punctul său de topire este de -7,2 °C. Bromul este un element chimic coroziv și poate provoca arsuri severe la contactul cu pielea. Bromul este un element chimic toxic și trebuie manipulat cu precauție în laboratoarele chimice.
Bromul este un element chimic important pentru sănătatea umană. De exemplu, ionul bromură este un element chimic esențial pentru funcționarea corectă a creierului și a sistemului nervos. Bromul este utilizat și în producția de medicamente, inclusiv în tratamentul epilepsiei și a altor afecțiuni neurologice.
Iodul ($I_2$)
Iodul este un element chimic cu simbolul I și numărul atomic 53. Este un halogen găsit în mod natural ca un solid diatomic, $I_2$. Molecula de iod este formată din doi atomi de iod legați covalent printr-o legătură simplă. Iodul este un element chimic relativ reactiv, dar mai puțin reactiv decât bromul. Iodul este utilizat în diverse aplicații industriale, inclusiv în producția de dezinfectanți, medicamente și coloranți.
Iodul este un solid gri-violet, cu un miros caracteristic. Punctul său de fierbere este de 184,3 °C, iar punctul său de topire este de 113,7 °C. Iodul este un element chimic coroziv și poate provoca arsuri severe la contactul cu pielea. Iodul este un element chimic toxic și trebuie manipulat cu precauție în laboratoarele chimice.
Iodul este un element chimic important pentru sănătatea umană. De exemplu, iodul este esențial pentru sinteza hormonilor tiroidieni, care joacă un rol crucial în metabolismul celular și în creșterea și dezvoltarea organismului. Deficiența de iod poate duce la probleme de sănătate grave, inclusiv la gușă și la retard mental.
Proprietățile elementelor diatomice
Elementele diatomice prezintă o varietate de proprietăți chimice, determinate de natura legăturilor covalente dintre atomii lor.
Proprietăți chimice
Proprietățile chimice ale elementelor diatomice sunt determinate în principal de natura legăturilor covalente dintre atomii lor. Aceste legături sunt formate prin împărțirea perechilor de electroni între atomii care formează molecula. Rezultatul este o structură stabilă, cu o energie mai mică decât atomii individuali.
Un aspect important al proprietăților chimice ale elementelor diatomice este reactivitatea lor. De exemplu, hidrogenul ($H_2$) este un element foarte reactiv, participând la o gamă largă de reacții chimice, inclusiv reacții de combustie. Azotul ($N_2$) este mai puțin reactiv, datorită triplei legături covalente puternice dintre atomii săi, ceea ce face ca ruperea acestei legături să fie dificilă. Oxigenul ($O_2$) este un oxidant puternic, esențial pentru respirația animalelor și pentru multe reacții chimice. Fluorul ($F_2$) este cel mai reactiv element din tabelul periodic, formând cu ușurință legături cu o varietate de elemente.
Reactivitatea elementelor diatomice poate fi influențată de factori precum temperatura și presiunea. La temperaturi ridicate, multe elemente diatomice devin mai reactive, deoarece energia termică poate rupe legăturile covalente și poate facilita reacțiile chimice. De asemenea, presiunea poate influența reactivitatea, deoarece poate afecta concentrația reactivelor și poate facilita formarea de noi legături.
Proprietăți fizice
Proprietățile fizice ale elementelor diatomice sunt determinate de structura moleculară, de interacțiunile intermoleculare și de forțele de atracție dintre molecule. Aceste proprietăți includ starea de agregare, punctul de topire, punctul de fierbere, densitatea și conductivitatea electrică.
La temperatura și presiunea standard, majoritatea elementelor diatomice se află în stare gazoasă. De exemplu, hidrogenul ($H_2$), azotul ($N_2$), oxigenul ($O_2$), fluorul ($F_2$) și clorul ($Cl_2$) sunt gaze. Bromul ($Br_2$) este un lichid, iar iodul ($I_2$) este un solid. Această variație a stării de agregare este legată de forțele intermoleculare, care sunt mai puternice în cazul bromului și iodului, determinând o temperatură de topire și fierbere mai ridicată.
Punctul de topire și punctul de fierbere ale elementelor diatomice sunt, de asemenea, influențate de masa moleculară. Cu cât masa moleculară este mai mare, cu atât forțele intermoleculare sunt mai puternice și cu atât punctul de topire și punctul de fierbere sunt mai ridicate. De exemplu, iodul ($I_2$) are un punct de topire și un punct de fierbere mai ridicate decât clorul ($Cl_2$), deoarece masa moleculară a iodului este mai mare.
Importanța elementelor diatomice
Elementele diatomice joacă un rol esențial în natură, industrie și viața de zi cu zi.
În natură
Elementele diatomice sunt omniprezente în natură, având un impact semnificativ asupra ecosistemelor și a vieții pe Pământ. De exemplu, oxigenul ($O_2$), un element diatomic, este esențial pentru respirația majorității organismelor vii, inclusiv a oamenilor. Plantele, prin fotosinteză, eliberează oxigen în atmosferă, contribuind la menținerea echilibrului gazelor din aer. Azotul ($N_2$), de asemenea un element diatomic, este componentul majoritar al atmosferei terestre, jucând un rol crucial în ciclul azotului, un proces esențial pentru creșterea plantelor și a altor organisme.
Hidrogenul ($H_2$), cel mai ușor element diatomic, este o componentă majoră a apei, un element vital pentru toate formele de viață. De asemenea, hidrogenul este prezent în stele, fiind o componentă vitală a proceselor nucleare care generează energie. Fluorul ($F_2$) se găsește în mod natural în minerale, în timp ce clorul ($Cl_2$) este prezent în apa de mare și în alte corpuri de apă.
Bromul ($Br_2$) și iodul ($I_2$) sunt elemente diatomice rare, dar esențiale pentru anumite funcții biologice. Bromul este prezent în mod natural în apa de mare și în anumite plante, în timp ce iodul este o componentă importantă a hormonilor tiroidieni, esențiali pentru dezvoltarea și funcționarea organismului uman.
În industrie
Elementele diatomice joacă un rol esențial în diverse industrii, contribuind la dezvoltarea tehnologiilor moderne și la fabricarea unor produse de larg consum. Oxigenul ($O_2$), de exemplu, este utilizat pe scară largă în industria metalurgică, în producția de oțel și în tăierea cu flacără. Azotul ($N_2$) este utilizat ca gaz inert în industria alimentară, în ambalarea alimentelor și în producția de îngrășăminte. Hidrogenul ($H_2$) este utilizat ca combustibil în motoarele cu combustie internă și în industria chimică, unde este utilizat pentru sinteza amoniacului și a altor compuși.
Fluorul ($F_2$) este utilizat în producția de fluorură de polivinil (PVC), un material plastic cu o gamă largă de aplicații, de la țevi și conducte la îmbrăcăminte și ambalaje. Clorul ($Cl_2$) este utilizat în industria chimică pentru producerea de clorură de vinil, un material plastic utilizat în producția de PVC, precum și în tratarea apei potabile și a apelor uzate. Bromul ($Br_2$) este utilizat în industria farmaceutică, în producția de medicamente și în industria chimică, în producția de substanțe chimice organice.
Iodul ($I_2$) este utilizat în industria farmaceutică, în producția de dezinfectanți și în industria alimentară, în producția de sare iodată, esențială pentru sănătatea organismului uman.
Articolul este bine scris și ușor de înțeles, oferind o introducere clară în conceptul elementelor diatomice. Ar fi util să se adauge o secțiune care să prezinte o discuție mai aprofundată a importanței elementelor diatomice în diverse domenii, de exemplu, în biologie, în chimie organică sau în fizica nucleară.
Articolul prezintă o introducere clară și concisă în conceptul elementelor diatomice, evidențiind importanța lor în diverse domenii. Definiția elementelor diatomice este prezentată într-un mod accesibil, iar exemplele oferite sunt relevante și ușor de înțeles. Totuși, ar fi util să se includă o secțiune dedicată proprietăților chimice și fizice ale fiecărui element diatomic, precum și o discuție mai aprofundată a legăturilor covalente care le stabilizează.
Lucrarea abordează un subiect important din chimia generală, oferind o perspectivă clară asupra elementelor diatomice. Prezentarea este bine structurată, iar terminologia utilizată este adecvată. Ar fi util să se adauge o secțiune care să exploreze aplicațiile practice ale elementelor diatomice, de exemplu, în industria chimică, în medicină sau în tehnologia modernă.
Articolul oferă o introducere clară și concisă în conceptul elementelor diatomice, evidențiând importanța lor în diverse domenii. Ar fi util să se includă o secțiune care să prezinte o discuție mai aprofundată a proprietăților fizice ale elementelor diatomice, de exemplu, punctele de topire și fierbere, densitatea, conductivitatea electrică și termică.
Lucrarea prezintă o abordare sistematică a elementelor diatomice, oferind o definiție clară și exemple relevante. Ar fi util să se includă o secțiune care să descrie modul în care elementele diatomice sunt obținute în laborator sau în industrie, precum și o discuție despre metodele de analiză a acestora.
Lucrarea abordează un subiect important din chimia generală, oferind o perspectivă clară asupra elementelor diatomice. Prezentarea este bine structurată, iar terminologia utilizată este adecvată. Ar fi util să se includă o secțiune care să prezinte o discuție mai aprofundată a reacțiilor chimice în care sunt implicate elementele diatomice, inclusiv mecanismele de reacție și factorii care influențează viteza de reacție.
Articolul este bine scris și ușor de înțeles, oferind o introducere clară în conceptul elementelor diatomice. Ar fi util să se adauge o secțiune care să prezinte o discuție mai aprofundată a importanței elementelor diatomice în diverse procese biologice, de exemplu, în respirația celulară, în fotosinteză sau în metabolismul celular.
Lucrarea prezintă o introducere convingătoare în subiectul elementelor diatomice, evidențiind importanța lor în diverse procese. Ar fi util să se includă o secțiune care să prezinte o discuție mai aprofundată a legăturilor covalente, inclusiv tipurile de legături covalente și factorii care influențează stabilitatea lor.