Tabelul periodic al elementelor: Un instrument esențial pentru chimie
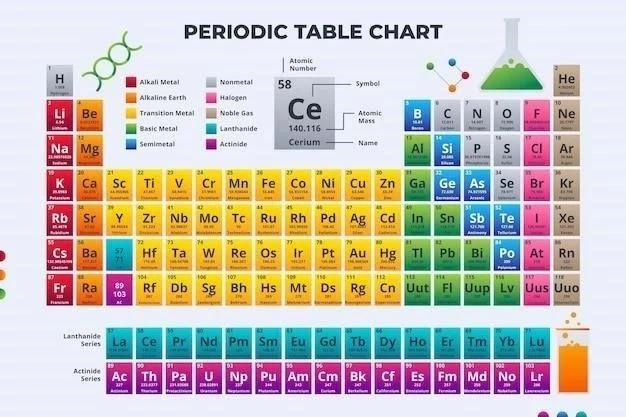

Tabelul periodic al elementelor este o reprezentare organizată a tuturor elementelor chimice cunoscute, aranjate în funcție de numărul atomic crescător și de proprietățile chimice similare. Este un instrument esențial în chimie, oferind o perspectivă asupra structurii atomice, proprietăților chimice și comportamentului elementelor.
Tabelul periodic al elementelor este un instrument fundamental în chimie, oferind o clasificare sistematică a tuturor elementelor chimice cunoscute, aranjate în funcție de numărul atomic crescător și de proprietățile chimice similare. Această organizare permite o înțelegere mai profundă a relațiilor dintre elemente și a modului în care acestea interacționează în reacțiile chimice. Un aspect important al tabelului periodic este prezentarea sarcinilor comune ale ionilor, o informație crucială pentru înțelegerea formării compușilor ionici și a reacțiilor chimice.
Un tabel periodic imprimabil cu sarcinile comune ale ionilor este un instrument util pentru studenții de chimie, profesori și cercetători, oferind o referință rapidă la informații esențiale. Acesta facilitează o înțelegere mai intuitivă a modului în care elementele formează ioni și a implicațiilor acestor sarcini în reacțiile chimice. De asemenea, permite o predicție mai ușoară a sarcinilor ionilor necunoscuți, bazându-se pe tendințele observate în tabel.
Tabelul periodic al elementelor este un instrument fundamental în chimie, oferind o clasificare sistematică a tuturor elementelor chimice cunoscute, aranjate în funcție de numărul atomic crescător și de proprietățile chimice similare. Această organizare permite o înțelegere mai profundă a relațiilor dintre elemente și a modului în care acestea interacționează în reacțiile chimice. Un aspect important al tabelului periodic este prezentarea sarcinilor comune ale ionilor, o informație crucială pentru înțelegerea formării compușilor ionici și a reacțiilor chimice.
Un tabel periodic imprimabil cu sarcinile comune ale ionilor este un instrument util pentru studenții de chimie, profesori și cercetători, oferind o referință rapidă la informații esențiale. Acesta facilitează o înțelegere mai intuitivă a modului în care elementele formează ioni și a implicațiilor acestor sarcini în reacțiile chimice. De asemenea, permite o predicție mai ușoară a sarcinilor ionilor necunoscuți, bazându-se pe tendințele observate în tabel.
Fiecare element din tabelul periodic este caracterizat de un set unic de proprietăți chimice și fizice, care sunt determinate de structura sa atomică. Un aspect important al tabelului periodic este prezentarea sarcinilor comune ale ionilor, o informație crucială pentru înțelegerea formării compușilor ionici și a reacțiilor chimice. Un tabel periodic imprimabil cu sarcinile comune ale ionilor este un instrument util pentru studenții de chimie, profesori și cercetători, oferind o referință rapidă la informații esențiale. Acesta facilitează o înțelegere mai intuitivă a modului în care elementele formează ioni și a implicațiilor acestor sarcini în reacțiile chimice. De asemenea, permite o predicție mai ușoară a sarcinilor ionilor necunoscuți, bazându-se pe tendințele observate în tabel.
Tabelul periodic al elementelor este un instrument fundamental în chimie, oferind o clasificare sistematică a tuturor elementelor chimice cunoscute, aranjate în funcție de numărul atomic crescător și de proprietățile chimice similare. Această organizare permite o înțelegere mai profundă a relațiilor dintre elemente și a modului în care acestea interacționează în reacțiile chimice. Un aspect important al tabelului periodic este prezentarea sarcinilor comune ale ionilor, o informație crucială pentru înțelegerea formării compușilor ionici și a reacțiilor chimice.
Un tabel periodic imprimabil cu sarcinile comune ale ionilor este un instrument util pentru studenții de chimie, profesori și cercetători, oferind o referință rapidă la informații esențiale. Acesta facilitează o înțelegere mai intuitivă a modului în care elementele formează ioni și a implicațiilor acestor sarcini în reacțiile chimice. De asemenea, permite o predicție mai ușoară a sarcinilor ionilor necunoscuți, bazându-se pe tendințele observate în tabel.
Fiecare element din tabelul periodic este caracterizat de un set unic de proprietăți chimice și fizice, care sunt determinate de structura sa atomică. Un aspect important al tabelului periodic este prezentarea sarcinilor comune ale ionilor, o informație crucială pentru înțelegerea formării compușilor ionici și a reacțiilor chimice. Un tabel periodic imprimabil cu sarcinile comune ale ionilor este un instrument util pentru studenții de chimie, profesori și cercetători, oferind o referință rapidă la informații esențiale. Acesta facilitează o înțelegere mai intuitivă a modului în care elementele formează ioni și a implicațiilor acestor sarcini în reacțiile chimice; De asemenea, permite o predicție mai ușoară a sarcinilor ionilor necunoscuți, bazându-se pe tendințele observate în tabel.
Numărul Atomic și Masa Atomică
Numărul atomic (Z) al unui element reprezintă numărul de protoni din nucleul atomului său. Acesta determină identitatea elementului și poziția sa în tabelul periodic. Masa atomică (A) a unui element este o măsură a masei medii a atomilor săi, luând în considerare abundența izotopilor săi naturali. Masa atomică este aproximativ egală cu suma numărului de protoni și neutroni din nucleu. De exemplu, hidrogenul (H) are numărul atomic 1 și masa atomică 1,008 u.a.m. (unități de masă atomică). Această informație este esențială pentru înțelegerea proprietăților chimice ale elementelor și pentru a calcula masele moleculare ale compușilor.
Tabelul periodic al elementelor este o reprezentare organizată a tuturor elementelor chimice cunoscute, aranjate în funcție de numărul atomic crescător și de proprietățile chimice similare. Este un instrument esențial în chimie, oferind o perspectivă asupra structurii atomice, proprietăților chimice și comportamentului elementelor.
Numărul Atomic și Masa Atomică
Numărul atomic (Z) al unui element reprezintă numărul de protoni din nucleul atomului său. Acesta determină identitatea elementului și poziția sa în tabelul periodic. Masa atomică (A) a unui element este o măsură a masei medii a atomilor săi, luând în considerare abundența izotopilor săi naturali. Masa atomică este aproximativ egală cu suma numărului de protoni și neutroni din nucleu. De exemplu, hidrogenul (H) are numărul atomic 1 și masa atomică 1,008 u.a.m. (unități de masă atomică). Această informație este esențială pentru înțelegerea proprietăților chimice ale elementelor și pentru a calcula masele moleculare ale compușilor.
Configurația Electronică și Valența
Configurația electronică a unui atom descrie aranjarea electronilor în diferite niveluri de energie și subniveluri. Această configurație determină proprietățile chimice ale elementului, inclusiv tendința sa de a forma legături chimice. Valența unui element se referă la numărul de electroni de valență, adică electronii din ultimul nivel de energie, care participă la formarea legăturilor chimice. De exemplu, carbonul (C) are configurația electronică $1s^22s^22p^2$ și are 4 electroni de valență, ceea ce explică capacitatea sa de a forma 4 legături covalente. Înțelegerea configurației electronice și a valenței este esențială pentru a prezice comportamentul elementelor în reacțiile chimice și pentru a explica tendințele observate în tabelul periodic.
Tabelul periodic al elementelor este o reprezentare organizată a tuturor elementelor chimice cunoscute, aranjate în funcție de numărul atomic crescător și de proprietățile chimice similare. Este un instrument esențial în chimie, oferind o perspectivă asupra structurii atomice, proprietăților chimice și comportamentului elementelor.
Numărul Atomic și Masa Atomică
Numărul atomic (Z) al unui element reprezintă numărul de protoni din nucleul atomului său. Acesta determină identitatea elementului și poziția sa în tabelul periodic. Masa atomică (A) a unui element este o măsură a masei medii a atomilor săi, luând în considerare abundența izotopilor săi naturali. Masa atomică este aproximativ egală cu suma numărului de protoni și neutroni din nucleu. De exemplu, hidrogenul (H) are numărul atomic 1 și masa atomică 1,008 u.a.m. (unități de masă atomică). Această informație este esențială pentru înțelegerea proprietăților chimice ale elementelor și pentru a calcula masele moleculare ale compușilor.
Configurația Electronică și Valența
Configurația electronică a unui atom descrie aranjarea electronilor în diferite niveluri de energie și subniveluri. Această configurație determină proprietățile chimice ale elementului, inclusiv tendința sa de a forma legături chimice. Valența unui element se referă la numărul de electroni de valență, adică electronii din ultimul nivel de energie, care participă la formarea legăturilor chimice. De exemplu, carbonul (C) are configurația electronică $1s^22s^22p^2$ și are 4 electroni de valență, ceea ce explică capacitatea sa de a forma 4 legături covalente. Înțelegerea configurației electronice și a valenței este esențială pentru a prezice comportamentul elementelor în reacțiile chimice și pentru a explica tendințele observate în tabelul periodic.
Electronegativitatea și Reactivitatea
Electronegativitatea este o măsură a capacității unui atom de a atrage electronii într-o legătură chimică. Cu cât un atom este mai electronegativ, cu atât este mai probabil să atragă electroni de la alți atomi. Reactivitatea unui element se referă la cât de ușor reacționează cu alte substanțe. Elementele cu electronegativitate mare sunt de obicei mai reactive, deoarece au tendința de a forma legături ionice. De exemplu, fluorul (F) are cea mai mare electronegativitate din tabelul periodic, ceea ce explică reactivitatea sa ridicată. Înțelegerea electronegativității și a reactivității este crucială pentru a prezice comportamentul elementelor în reacțiile chimice și pentru a explica tendințele observate în tabelul periodic.
Tabelul periodic al elementelor este o reprezentare organizată a tuturor elementelor chimice cunoscute, aranjate în funcție de numărul atomic crescător și de proprietățile chimice similare. Este un instrument esențial în chimie, oferind o perspectivă asupra structurii atomice, proprietăților chimice și comportamentului elementelor.
Numărul Atomic și Masa Atomică
Numărul atomic (Z) al unui element reprezintă numărul de protoni din nucleul atomului său. Acesta determină identitatea elementului și poziția sa în tabelul periodic. Masa atomică (A) a unui element este o măsură a masei medii a atomilor săi, luând în considerare abundența izotopilor săi naturali. Masa atomică este aproximativ egală cu suma numărului de protoni și neutroni din nucleu. De exemplu, hidrogenul (H) are numărul atomic 1 și masa atomică 1,008 u.a.m. (unități de masă atomică). Această informație este esențială pentru înțelegerea proprietăților chimice ale elementelor și pentru a calcula masele moleculare ale compușilor.
Configurația Electronică și Valența
Configurația electronică a unui atom descrie aranjarea electronilor în diferite niveluri de energie și subniveluri. Această configurație determină proprietățile chimice ale elementului, inclusiv tendința sa de a forma legături chimice. Valența unui element se referă la numărul de electroni de valență, adică electronii din ultimul nivel de energie, care participă la formarea legăturilor chimice. De exemplu, carbonul (C) are configurația electronică $1s^22s^22p^2$ și are 4 electroni de valență, ceea ce explică capacitatea sa de a forma 4 legături covalente. Înțelegerea configurației electronice și a valenței este esențială pentru a prezice comportamentul elementelor în reacțiile chimice și pentru a explica tendințele observate în tabelul periodic.
Electronegativitatea și Reactivitatea
Electronegativitatea este o măsură a capacității unui atom de a atrage electronii într-o legătură chimică. Cu cât un atom este mai electronegativ, cu atât este mai probabil să atragă electroni de la alți atomi. Reactivitatea unui element se referă la cât de ușor reacționează cu alte substanțe. Elementele cu electronegativitate mare sunt de obicei mai reactive, deoarece au tendința de a forma legături ionice. De exemplu, fluorul (F) are cea mai mare electronegativitate din tabelul periodic, ceea ce explică reactivitatea sa ridicată. Înțelegerea electronegativității și a reactivității este crucială pentru a prezice comportamentul elementelor în reacțiile chimice și pentru a explica tendințele observate în tabelul periodic.
Proprietățile chimice ale elementelor variază în mod regulat în tabelul periodic, reflectând tendințele periodice. Aceste tendințe sunt determinate de configurația electronică a atomilor și de forțele interatomice. Există mai multe tendințe periodice importante, inclusiv raza atomică, energia de ionizare, afinitatea electronică și electronegativitatea. Aceste tendințe permit prezicerea proprietăților chimice ale elementelor și explicarea comportamentului lor în reacțiile chimice.
Tabelul periodic al elementelor este o reprezentare organizată a tuturor elementelor chimice cunoscute, aranjate în funcție de numărul atomic crescător și de proprietățile chimice similare. Este un instrument esențial în chimie, oferind o perspectivă asupra structurii atomice, proprietăților chimice și comportamentului elementelor.
Numărul Atomic și Masa Atomică
Numărul atomic (Z) al unui element reprezintă numărul de protoni din nucleul atomului său. Acesta determină identitatea elementului și poziția sa în tabelul periodic; Masa atomică (A) a unui element este o măsură a masei medii a atomilor săi, luând în considerare abundența izotopilor săi naturali. Masa atomică este aproximativ egală cu suma numărului de protoni și neutroni din nucleu. De exemplu, hidrogenul (H) are numărul atomic 1 și masa atomică 1,008 u.a.m. (unități de masă atomică). Această informație este esențială pentru înțelegerea proprietăților chimice ale elementelor și pentru a calcula masele moleculare ale compușilor.
Configurația Electronică și Valența
Configurația electronică a unui atom descrie aranjarea electronilor în diferite niveluri de energie și subniveluri. Această configurație determină proprietățile chimice ale elementului, inclusiv tendința sa de a forma legături chimice. Valența unui element se referă la numărul de electroni de valență, adică electronii din ultimul nivel de energie, care participă la formarea legăturilor chimice. De exemplu, carbonul (C) are configurația electronică $1s^22s^22p^2$ și are 4 electroni de valență, ceea ce explică capacitatea sa de a forma 4 legături covalente. Înțelegerea configurației electronice și a valenței este esențială pentru a prezice comportamentul elementelor în reacțiile chimice și pentru a explica tendințele observate în tabelul periodic.
Electronegativitatea și Reactivitatea
Electronegativitatea este o măsură a capacității unui atom de a atrage electronii într-o legătură chimică. Cu cât un atom este mai electronegativ, cu atât este mai probabil să atragă electroni de la alți atomi. Reactivitatea unui element se referă la cât de ușor reacționează cu alte substanțe. Elementele cu electronegativitate mare sunt de obicei mai reactive, deoarece au tendința de a forma legături ionice. De exemplu, fluorul (F) are cea mai mare electronegativitate din tabelul periodic, ceea ce explică reactivitatea sa ridicată. Înțelegerea electronegativității și a reactivității este crucială pentru a prezice comportamentul elementelor în reacțiile chimice și pentru a explica tendințele observate în tabelul periodic.
Proprietățile chimice ale elementelor variază în mod regulat în tabelul periodic, reflectând tendințele periodice. Aceste tendințe sunt determinate de configurația electronică a atomilor și de forțele interatomice. Există mai multe tendințe periodice importante, inclusiv raza atomică, energia de ionizare, afinitatea electronică și electronegativitatea. Aceste tendințe permit prezicerea proprietăților chimice ale elementelor și explicarea comportamentului lor în reacțiile chimice.
Raza Atomică
Raza atomică este o măsură a dimensiunii unui atom. Aceasta variază în funcție de poziția elementului în tabelul periodic. În general, raza atomică crește în josul grupelor și scade de-a lungul perioadelor. Această tendință este explicată de creșterea numărului de niveluri de energie și de ecranarea electronilor de valență de către electronii din nivelurile interioare. O rază atomică mai mare înseamnă că electronii de valență sunt mai departe de nucleu și sunt mai ușor de îndepărtat, ceea ce explică tendința de a forma legături chimice mai slabe.
Tabelul Periodic⁚ O Privire Generală
Introducere
Tabelul periodic al elementelor este o reprezentare organizată a tuturor elementelor chimice cunoscute, aranjate în funcție de numărul atomic crescător și de proprietățile chimice similare. Este un instrument esențial în chimie, oferind o perspectivă asupra structurii atomice, proprietăților chimice și comportamentului elementelor.
Elementele și Proprietățile lor
Numărul Atomic și Masa Atomică
Numărul atomic (Z) al unui element reprezintă numărul de protoni din nucleul atomului său. Acesta determină identitatea elementului și poziția sa în tabelul periodic. Masa atomică (A) a unui element este o măsură a masei medii a atomilor săi, luând în considerare abundența izotopilor săi naturali. Masa atomică este aproximativ egală cu suma numărului de protoni și neutroni din nucleu. De exemplu, hidrogenul (H) are numărul atomic 1 și masa atomică 1,008 u.a.m. (unități de masă atomică). Această informație este esențială pentru înțelegerea proprietăților chimice ale elementelor și pentru a calcula masele moleculare ale compușilor.
Configurația Electronică și Valența
Configurația electronică a unui atom descrie aranjarea electronilor în diferite niveluri de energie și subniveluri. Această configurație determină proprietățile chimice ale elementului, inclusiv tendința sa de a forma legături chimice. Valența unui element se referă la numărul de electroni de valență, adică electronii din ultimul nivel de energie, care participă la formarea legăturilor chimice. De exemplu, carbonul (C) are configurația electronică $1s^22s^22p^2$ și are 4 electroni de valență, ceea ce explică capacitatea sa de a forma 4 legături covalente. Înțelegerea configurației electronice și a valenței este esențială pentru a prezice comportamentul elementelor în reacțiile chimice și pentru a explica tendințele observate în tabelul periodic.
Electronegativitatea și Reactivitatea
Electronegativitatea este o măsură a capacității unui atom de a atrage electronii într-o legătură chimică. Cu cât un atom este mai electronegativ, cu atât este mai probabil să atragă electroni de la alți atomi. Reactivitatea unui element se referă la cât de ușor reacționează cu alte substanțe. Elementele cu electronegativitate mare sunt de obicei mai reactive, deoarece au tendința de a forma legături ionice. De exemplu, fluorul (F) are cea mai mare electronegativitate din tabelul periodic, ceea ce explică reactivitatea sa ridicată. Înțelegerea electronegativității și a reactivității este crucială pentru a prezice comportamentul elementelor în reacțiile chimice și pentru a explica tendințele observate în tabelul periodic.
Tendințele Perioadice
Proprietățile chimice ale elementelor variază în mod regulat în tabelul periodic, reflectând tendințele periodice. Aceste tendințe sunt determinate de configurația electronică a atomilor și de forțele interatomice. Există mai multe tendințe periodice importante, inclusiv raza atomică, energia de ionizare, afinitatea electronică și electronegativitatea. Aceste tendințe permit prezicerea proprietăților chimice ale elementelor și explicarea comportamentului lor în reacțiile chimice.
Raza Atomică
Raza atomică este o măsură a dimensiunii unui atom. Aceasta variază în funcție de poziția elementului în tabelul periodic. În general, raza atomică crește în josul grupelor și scade de-a lungul perioadelor. Această tendință este explicată de creșterea numărului de niveluri de energie și de ecranarea electronilor de valență de către electronii din nivelurile interioare. O rază atomică mai mare înseamnă că electronii de valență sunt mai departe de nucleu și sunt mai ușor de îndepărtat, ceea ce explică tendința de a forma legături chimice mai slabe.
Energia de Ionizare
Energia de ionizare este energia minimă necesară pentru a îndepărta un electron dintr-un atom neutru în faza gazoasă, formând un ion pozitiv. Această energie este o măsură a tendinței unui atom de a pierde electroni. Energia de ionizare crește de-a lungul perioadelor și scade în josul grupelor. Această tendință este explicată de creșterea atracției nucleare și de scăderea ecranării electronilor de valență de către electronii din nivelurile interioare. O energie de ionizare mai mare înseamnă că electronii de valență sunt mai strâns legați de nucleu și sunt mai greu de îndepărtat, ceea ce explică tendința de a forma ioni pozitivi mai puțin ușor.