Periodicitatea în tabelul periodic
Ce este periodicitatea în tabelul periodic?
Periodicitatea în tabelul periodic se referă la tendințele regulate ale proprietăților chimice ale elementelor, așa cum sunt aranjate în funcție de numărul atomic crescător․ Această periodicitate este o consecință a configurației electronice a atomilor, care determină modul în care aceștia interacționează cu alți atomi․
Introducere
Tabelul periodic al elementelor este un instrument esențial în chimie, oferind o organizare sistematică a elementelor chimice în funcție de proprietățile lor․ Această organizare nu este întâmplătoare, ci se bazează pe o lege fundamentală a naturii⁚ legea periodică․ Legea periodică afirmă că proprietățile chimice ale elementelor variază periodic în funcție de numărul atomic crescător․ Cu alte cuvinte, elementele cu numere atomice similare au tendința de a prezenta proprietăți chimice asemănătoare․
Periodicitatea în tabelul periodic se manifestă prin tendințe regulate ale proprietăților chimice ale elementelor, cum ar fi electronegativitatea, energia de ionizare, raza atomică și caracterul metalic․ Aceste tendințe sunt o consecință a configurației electronice a atomilor, care determină modul în care aceștia interacționează cu alți atomi․ Înțelegerea periodicității este esențială pentru a prezice și a explica comportamentul chimic al elementelor, precum și pentru a înțelege legăturile chimice și reacțiile chimice․
Tabelul periodic⁚ O privire de ansamblu
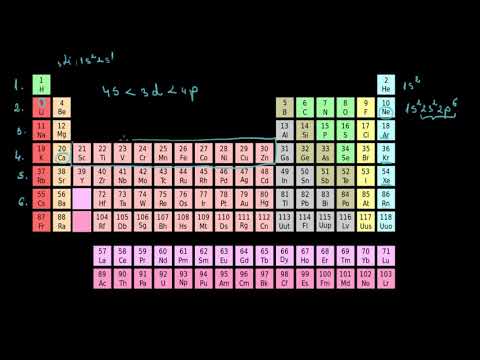
Tabelul periodic al elementelor este o reprezentare grafică a tuturor elementelor chimice cunoscute, aranjate în funcție de numărul atomic crescător․ Elementele sunt grupate în rânduri numite perioade și coloane numite grupe․ Numărul perioadei indică nivelul energetic principal al electronilor de valență ai elementului, în timp ce numărul grupei indică numărul de electroni de valență․
Tabelul periodic este împărțit în blocuri, fiecare bloc corespunzând unui anumit tip de orbital atomic․ Blocul s include elementele cu electroni de valență în orbitali s, blocul p include elementele cu electroni de valență în orbitali p, blocul d include elementele cu electroni de valență în orbitali d, iar blocul f include elementele cu electroni de valență în orbitali f․ Această organizare a tabelului periodic reflectă configurația electronică a atomilor și permite o înțelegere mai profundă a proprietăților chimice ale elementelor․
Elementele și proprietățile lor chimice
Fiecare element din tabelul periodic are un set unic de proprietăți chimice, determinate de configurația electronică a atomilor săi․ Proprietățile chimice ale elementelor variază în mod regulat pe parcursul tabelului periodic, reflectând tendințele periodice․ De exemplu, elementele din aceeași grupă au un număr similar de electroni de valență, ceea ce le conferă proprietăți chimice similare․
Un element este definit prin numărul său atomic, care reprezintă numărul de protoni din nucleul atomului․ Numărul atomic determină identitatea elementului și influențează proprietățile sale chimice․ Configurația electronică a unui atom descrie modul în care electronii sunt aranjați în jurul nucleului․ Configurația electronică determină proprietățile chimice ale unui element, inclusiv reactivitatea sa․
Numărul atomic și configurația electronică
Numărul atomic al unui element reprezintă numărul de protoni din nucleul atomului․ Această valoare este fundamentală pentru identitatea elementului și este reprezentată de simbolul Z․ Numărul atomic este, de asemenea, egal cu numărul de electroni din atomul neutru․ Configurația electronică a unui atom descrie modul în care electronii sunt aranjați în jurul nucleului, ocupând diferite nivele de energie și subnivele․
Configurația electronică este crucială pentru înțelegerea proprietăților chimice ale unui element, deoarece electronii de valență, cei din ultimul nivel de energie, sunt cei implicați în formarea legăturilor chimice․ Periodicitatea în tabelul periodic este o consecință directă a configurației electronice․ Elementele din aceeași grupă au un număr similar de electroni de valență, ceea ce explică similaritățile în proprietățile lor chimice․
Tendințele în tabelul periodic
Proprietățile chimice ale elementelor prezintă tendințe regulate pe măsură ce ne deplasăm prin tabelul periodic․ Aceste tendințe sunt o consecință a variației configurației electronice a atomilor․ Există mai multe proprietăți chimice care prezintă periodicitate⁚
- Raza atomică⁚ Raza atomică descrește de la stânga la dreapta într-o perioadă, deoarece sarcina nucleară crește, atrăgând mai puternic electronii de valență․ Raza atomică crește de sus în jos într-o grupă, deoarece se adaugă noi nivele de energie, iar electronii de valență sunt mai îndepărtați de nucleu․
- Energia de ionizare⁚ Energia de ionizare este energia necesară pentru a îndepărta un electron de la un atom neutru în stare gazoasă․ Energia de ionizare crește de la stânga la dreapta într-o perioadă și descrește de sus în jos într-o grupă, din aceleași motive ca și variația razei atomice․
- Electronegativitatea⁚ Electronegativitatea este capacitatea unui atom de a atrage electroni într-o legătură chimică․ Electronegativitatea crește de la stânga la dreapta într-o perioadă și descrește de sus în jos într-o grupă․
- Caracterul metalic⁚ Caracterul metalic este tendința unui element de a pierde electroni și de a forma cationi․ Caracterul metalic descrește de la stânga la dreapta într-o perioadă și crește de sus în jos într-o grupă․
Rânduri (perioade) și coloane (grupe)
Tabelul periodic este organizat în rânduri și coloane, care reflectă periodicitatea proprietăților chimice ale elementelor․ Rândurile se numesc perioade și indică numărul de nivele de energie ale atomilor․ Există șapte perioade în tabelul periodic, fiecare corespunzând unui nivel de energie principal al atomilor․ De exemplu, elementele din perioada 1 au un singur nivel de energie, iar elementele din perioada 2 au două nivele de energie․
Coloanele se numesc grupe și indică numărul de electroni de valență ai atomilor․ Există 18 grupe în tabelul periodic, numerotate de la 1 la 18․ Elementele din aceeași grupă au proprietăți chimice similare deoarece au același număr de electroni de valență, care sunt implicați în formarea legăturilor chimice․ De exemplu, elementele din grupa 1, cunoscute ca metale alcaline, au un electron de valență și sunt foarte reactive․
Reactivitate
Reactivitatea elementelor, adică tendința lor de a participa la reacții chimice, este o proprietate periodică․ În general, elementele din stânga tabelului periodic, metalele, sunt mai reactive decât elementele din dreapta, nemetalele․ Această tendință este determinată de ușurința cu care atomii pierd sau câștigă electroni pentru a forma legături chimice․ Metalele au tendința de a pierde electroni, formând ioni pozitivi, în timp ce nemetalele au tendința de a câștiga electroni, formând ioni negativi․
De-a lungul unei perioade, reactivitatea metalelor scade, iar reactivitatea nemetalelor crește․ Acest lucru se datorează faptului că atomii din dreapta tabelului periodic au o atracție mai puternică pentru electronii lor de valență, ceea ce face mai dificilă pierderea sau câștigarea lor․ De-a lungul unei grupe, reactivitatea metalelor crește, iar reactivitatea nemetalelor scade․ Această tendință este legată de creșterea dimensiunii atomice, ceea ce face mai ușor pentru atomii din partea de jos a tabelului periodic să piardă sau să câștige electroni․
Electronegativitate
Electronegativitatea este o măsură a atracției unui atom pentru electronii dintr-o legătură chimică․ Cu cât electronegativitatea unui atom este mai mare, cu atât are o atracție mai puternică pentru electronii de legătură․ Această proprietate este influențată de factori precum numărul de protoni din nucleu și distanța dintre nucleu și electronii de valență․
În tabelul periodic, electronegativitatea crește de-a lungul unei perioade, de la stânga la dreapta․ Acest lucru se datorează faptului că atomii din dreapta tabelului periodic au mai mulți protoni în nucleu, ceea ce exercită o atracție mai puternică asupra electronilor․ De-a lungul unei grupe, electronegativitatea scade de sus în jos; Această tendință este legată de creșterea dimensiunii atomice, ceea ce face ca atracția dintre nucleu și electronii de valență să fie mai slabă․
Energia de ionizare
Energia de ionizare este energia minimă necesară pentru a elimina un electron dintr-un atom aflat în starea sa fundamentală, formând un ion pozitiv․ Această proprietate este o măsură a ușurinței cu care un atom poate pierde un electron․ Cu cât energia de ionizare este mai mică, cu atât este mai ușor de îndepărtat un electron․
În tabelul periodic, energia de ionizare crește de-a lungul unei perioade, de la stânga la dreapta․ Această tendință este legată de creșterea atracției nucleare asupra electronilor de valență, ceea ce face mai dificilă îndepărtarea unui electron․ De-a lungul unei grupe, energia de ionizare scade de sus în jos․ Această scădere se datorează creșterii dimensiunii atomice, ceea ce face ca atracția dintre nucleu și electronii de valență să fie mai slabă․
Raza atomică
Raza atomică se referă la distanța medie dintre nucleul unui atom și electronul său cel mai exterior․ Această proprietate este o măsură a dimensiunii unui atom․ Raza atomică este o proprietate periodică, variind în funcție de poziția elementului în tabelul periodic․
În general, raza atomică scade de-a lungul unei perioade, de la stânga la dreapta․ Această scădere se datorează creșterii atracției nucleare asupra electronilor de valență, ceea ce determină o contracție a norului electronic․ De-a lungul unei grupe, raza atomică crește de sus în jos․ Această creștere se datorează adăugării de noi niveluri de energie, ceea ce duce la o distanță mai mare între nucleu și electronii de valență․
Caracterul metalic
Caracterul metalic se referă la tendința unui element de a pierde electroni și de a forma cationi․ Această proprietate este o măsură a cât de ușor un element poate participa la legături metalice․ Caracterul metalic este o proprietate periodică, variind în funcție de poziția elementului în tabelul periodic․
În general, caracterul metalic crește de-a lungul unei grupe, de sus în jos․ Această creștere se datorează creșterii distanței dintre nucleu și electronii de valență, ceea ce face ca aceștia să fie mai ușor de îndepărtat․ De-a lungul unei perioade, caracterul metalic scade de la stânga la dreapta․ Această scădere se datorează creșterii atracției nucleare asupra electronilor de valență, ceea ce face ca aceștia să fie mai greu de îndepărtat․
Categorii de elemente
Elementele din tabelul periodic sunt clasificate în diferite categorii în funcție de proprietățile lor chimice și fizice․ Aceste categorii reflectă periodicitatea proprietăților elementelor și ajută la înțelegerea comportamentului lor․
- Metale⁚ Metalele sunt elemente care prezintă, în general, un luciu metalic, sunt bune conductoare de căldură și electricitate, sunt maleabile și ductile, și au tendința de a pierde electroni pentru a forma cationi․
- Nemetale⁚ Nemetalele prezintă o gamă largă de proprietăți, dar în general sunt slabe conductoare de căldură și electricitate, sunt fragile și au tendința de a câștiga electroni pentru a forma anioni․
- Metaloizi⁚ Metaloizii, cunoscuți și ca semimetale, prezintă proprietăți intermediare între metale și nemetale․ Ei pot prezenta caracteristici atât metalice, cât și nemetalice, în funcție de condițiile specifice․
Nemetale
Nemetalele sunt elemente care, în general, nu prezintă proprietățile caracteristice metalelor․ Ele sunt, de obicei, slabe conductoare de căldură și electricitate, fragile și au tendința de a câștiga electroni pentru a forma anioni․ Nemetalele se găsesc în partea dreaptă a tabelului periodic, cu excepția hidrogenului, care este plasat în partea stângă․
Exemple de nemetale includ⁚
- Oxigenul (O)⁚ Un element esențial pentru respirația organismelor vii și pentru multe procese chimice․
- Carbonul (C)⁚ Un element fundamental pentru viața organică și pentru multe materiale sintetice․
- Azotul (N)⁚ Un component major al atmosferei terestre și un element esențial pentru producția de îngrășăminte․
- Fluorul (F)⁚ Cel mai reactiv dintre toate nemetalele și un element important în stomatologie․
Metale
Metalele sunt elemente care prezintă proprietăți caracteristice, cum ar fi conductivitatea electrică și termică ridicată, maleabilitatea (capacitatea de a fi ciocănite în foi subțiri), ductilitatea (capacitatea de a fi trase în fire) și luciul metalic․ Aceste proprietăți sunt determinate de structura electronică a metalelor, care permite electronilor să se deplaseze liber prin rețeaua atomică․ Metalele se găsesc în partea stângă a tabelului periodic, cu excepția hidrogenului, care este un nemetal․
Exemple de metale includ⁚
- Fierul (Fe)⁚ Un metal important pentru construcții, industria auto și producția de oțel․
- Aurul (Au)⁚ Un metal prețios, inert chimic, folosit în bijuterii și electronică․
- Cuprul (Cu)⁚ Un metal excelent conductor de electricitate, utilizat în cabluri electrice și conducte․
- Argintul (Ag)⁚ Un metal prețios, cu conductivitate electrică ridicată, utilizat în bijuterii și oglinzi․
Metaloizi
Metaloizii, denumiți și semimetale, sunt elemente care prezintă proprietăți intermediare între metale și nemetale․ Aceștia se găsesc în tabelul periodic pe o linie diagonală care separă metalele de nemetale․ Metaloizii au o conductivitate electrică variabilă, care depinde de condițiile de temperatură și presiune․ De asemenea, pot prezenta caracteristici specifice metalelor, cum ar fi luciul metalic, dar și caracteristici specifice nemetalelor, cum ar fi fragilitatea․
Exemple de metaloizi includ⁚
- Siliconul (Si)⁚ Un element esențial în industria semiconductorilor, utilizat în fabricarea cipurilor electronice․
- Germaniul (Ge)⁚ Un metaloid utilizat în tranzistoare și celule solare․
- Arsenicul (As)⁚ Un metaloid toxic, utilizat în pesticide și aliaje․
- Antimoniul (Sb)⁚ Un metaloid utilizat în aliaje și materiale ignifuge․
Lantanide și actinite
Lantanidele și actinidele sunt două serii de elemente care apar în tabelul periodic sub tabelul principal․ Lantanidele, cu numerele atomice de la 57 la 71, sunt situate sub lantan (La), iar actinidele, cu numerele atomice de la 89 la 103, sunt situate sub actiniu (Ac)․ Aceste elemente sunt numite și elemente de tranziție interioare, deoarece ele prezintă o configurație electronică specială, cu electroni care se adaugă la orbitalii f․
Lantanidele sunt în general metale moi, reactive și au o culoare argintie․ Ele sunt utilizate în diverse aplicații, inclusiv în magneți, luminescență și cataliză․ Actinidele sunt metale radioactive și au o durată de viață scurtă․ Ele sunt utilizate în cercetarea nucleară și în fabricarea armelor nucleare․
Deși lantanidele și actinidele au proprietăți similare, ele prezintă și diferențe semnificative․ Lantanidele sunt mai stabile și mai puțin radioactive decât actinidele․ De asemenea, lantanidele sunt mai abundente în natură decât actinidele․
Legea periodică
Legea periodică este principiul fundamental care stă la baza organizării tabelului periodic․ Această lege afirmă că proprietățile chimice ale elementelor sunt o funcție periodică a numerelor lor atomice․ Cu alte cuvinte, proprietățile elementelor se repetă în mod regulat pe măsură ce numărul atomic crește․
Această lege a fost formulată inițial de Dmitri Mendeleev în 1869, care a observat că elementele cu proprietăți chimice similare apar la intervale regulate în tabelul periodic․ El a aranjat elementele în ordinea crescătoare a maselor atomice și a observat că elementele cu proprietăți similare apar la intervale regulate․
Cu toate acestea, legea periodică a fost ulterior reformulată de Henry Moseley în 1913, care a demonstrat că numărul atomic, nu masa atomică, este factorul determinant al periodicității; Moseley a descoperit că numărul atomic este egal cu numărul de protoni din nucleul unui atom, iar această descoperire a permis o înțelegere mai precisă a periodicității․
Contribuția lui Mendeleev
Dmitri Mendeleev, un chimist rus, a jucat un rol crucial în dezvoltarea legii periodice․ În 1869, el a publicat prima versiune a tabelului periodic, care a aranjat elementele în ordinea crescătoare a maselor atomice․ Mendeleev a observat că elementele cu proprietăți chimice similare apar la intervale regulate în tabelul său․ De exemplu, el a observat că litiul (Li), sodiul (Na) și potasiul (K) au proprietăți similare, la fel ca și beriliul (Be), magneziul (Mg) și calciul (Ca)․
Mendeleev a fost curajos în a lăsa spații goale în tabelul său pentru elementele care nu fuseseră încă descoperite․ El a prezis cu exactitate proprietățile acestor elemente necunoscute, bazându-se pe poziția lor în tabelul periodic․ De exemplu, el a prezis existența unui element numit “eka-silicon”, care a fost descoperit mai târziu și numit germaniu (Ge)․ Predicțiile lui Mendeleev au confirmat validitatea legii sale periodice și au demonstrat puterea tabelului periodic ca instrument de predicție․
Contribuția lui Moseley
Henry Moseley, un fizician britanic, a adus o contribuție semnificativă la înțelegerea legii periodice․ În 1913, Moseley a folosit raze X pentru a determina numărul atomic al elementelor․ El a descoperit că numărul atomic, care reprezintă numărul de protoni din nucleul unui atom, este o proprietate fundamentală a unui element și este responsabilă pentru periodicitatea proprietăților chimice․
Moseley a arătat că numărul atomic este o măsură mai precisă a poziției unui element în tabelul periodic decât masa atomică․ Aceasta a rezolvat unele anomalii din tabelul lui Mendeleev, cum ar fi inversarea poziției potasiului (K) și a argoului (Ar) în ordinea crescătoare a maselor atomice․ Tabelul periodic modern este aranjat în ordinea crescătoare a numerelor atomice, reflectând contribuția lui Moseley și confirmând importanța numărului atomic în determinarea proprietăților chimice ale elementelor․
Concluzie
Periodicitatea în tabelul periodic este un concept fundamental în chimie, care explică tendințele regulate ale proprietăților chimice ale elementelor․ Această periodicitate se bazează pe configurația electronică a atomilor, care determină modul în care aceștia interacționează cu alți atomi․ Tabelul periodic este un instrument esențial pentru chimiști, deoarece permite prezicerea și explicarea proprietăților chimice ale elementelor․
Înțelegerea periodicității este crucială pentru a înțelege reacțiile chimice, pentru a proiecta noi materiale și pentru a dezvolta noi tehnologii․ Studiul periodicității ne permite să explorăm diversitatea elementelor și să înțelegem legăturile dintre structura atomică și proprietățile chimice, contribuind la o mai bună înțelegere a lumii din jurul nostru․
Articolul oferă o introducere solidă în conceptul de periodicitate în tabelul periodic. Explicația legăturii dintre configurația electronică și proprietățile chimice este bine argumentată. Ar fi utilă adăugarea unor grafice sau diagrame pentru a vizualiza mai bine tendințele periodicității.
Articolul oferă o introducere solidă în conceptul de periodicitate în tabelul periodic. Explicația legăturii dintre configurația electronică și proprietățile chimice este bine argumentată. Ar fi utilă adăugarea unor exerciții practice pentru a consolida înțelegerea conceptului de periodicitate.
Articolul oferă o introducere solidă în conceptul de periodicitate în tabelul periodic. Explicația legăturii dintre configurația electronică și proprietățile chimice este bine argumentată. Ar fi utilă adăugarea unor referințe bibliografice pentru a susține informațiile prezentate.
Prezentarea tabelului periodic este bine structurată și ușor de înțeles. Explicația legii periodice este clară și concisă. Ar fi benefic să se includă o secțiune dedicată aplicațiilor practice ale periodicității, cum ar fi predicția proprietăților chimice ale unor elemente noi sau explicarea reacțiilor chimice.
Articolul prezintă o prezentare clară și concisă a conceptului de periodicitate în tabelul periodic. Explicația legăturii dintre configurația electronică și proprietățile chimice este bine argumentată. Ar fi utilă adăugarea unor exemple de elemente specifice pentru a ilustra mai bine tendințele periodicității.
Articolul prezintă o prezentare clară și concisă a conceptului de periodicitate în tabelul periodic. Explicația legăturii dintre configurația electronică și proprietățile chimice este bine argumentată. Ar fi utilă adăugarea unor ilustrații pentru a vizualiza mai bine structura tabelului periodic și tendințele periodicității.
Articolul prezintă o introducere clară și concisă a conceptului de periodicitate în tabelul periodic. Explicația legăturii dintre configurația electronică și proprietățile chimice este bine argumentată. Totuși, ar fi utilă adăugarea unor exemple concrete pentru a ilustra mai bine aceste tendințe, precum și o discuție mai aprofundată a excepțiilor de la regulile generale.
Articolul prezintă o prezentare clară și concisă a conceptului de periodicitate în tabelul periodic. Explicația legăturii dintre configurația electronică și proprietățile chimice este bine argumentată. Ar fi benefic să se includă o secțiune dedicată istoriei descoperirii legii periodice.