Atomul: Structura fundamentală a materiei

Exemple de atomi includ hidrogenul ($H$), carbonul ($C$), oxigenul ($O$) și aurul ($Au$)․
Atomul este unitatea fundamentală a materiei, cea mai mică particulă care păstrează proprietățile chimice ale unui element․ Este o structură complexă, formată din particule subatomice, care se află în continuă mișcare․ Atomii sunt atât de mici încât nu pot fi observați cu ochiul liber, ci doar cu ajutorul unor instrumente sofisticate, cum ar fi microscopul electronic․
Atomul este unitatea fundamentală a materiei, cea mai mică particulă care păstrează proprietățile chimice ale unui element․ Este o structură complexă, formată din particule subatomice, care se află în continuă mișcare․ Atomii sunt atât de mici încât nu pot fi observați cu ochiul liber, ci doar cu ajutorul unor instrumente sofisticate, cum ar fi microscopul electronic․
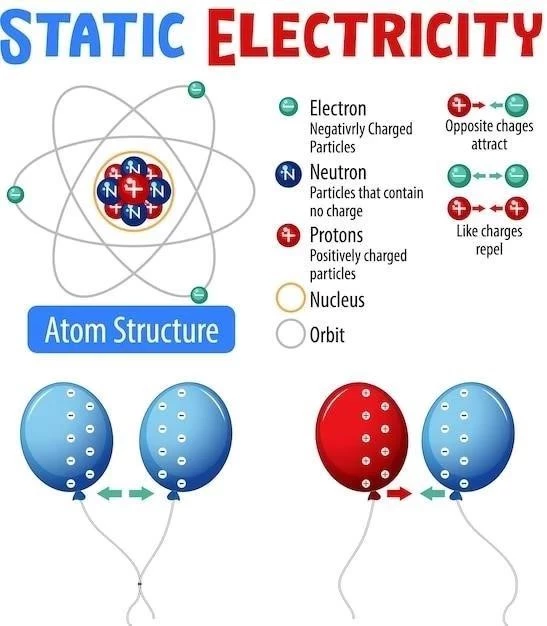
Atomii sunt formați din trei tipuri de particule subatomice⁚ protoni, neutroni și electroni․ Protoni și neutroni se găsesc în nucleul atomului, care este centrul atomului și ocupă o mică parte din volumul total al atomului․ Electronii se rotesc în jurul nucleului, formând un nor electronic․ Protonii au o sarcină electrică pozitivă (+1), neutronii sunt neutri din punct de vedere electric, iar electronii au o sarcină electrică negativă (-1)․
Atomul este unitatea fundamentală a materiei, cea mai mică particulă care păstrează proprietățile chimice ale unui element․ Este o structură complexă, formată din particule subatomice, care se află în continuă mișcare․ Atomii sunt atât de mici încât nu pot fi observați cu ochiul liber, ci doar cu ajutorul unor instrumente sofisticate, cum ar fi microscopul electronic;
Atomii sunt formați din trei tipuri de particule subatomice⁚ protoni, neutroni și electroni․ Protoni și neutroni se găsesc în nucleul atomului, care este centrul atomului și ocupă o mică parte din volumul total al atomului․ Electronii se rotesc în jurul nucleului, formând un nor electronic․ Protonii au o sarcină electrică pozitivă (+1), neutronii sunt neutri din punct de vedere electric, iar electronii au o sarcină electrică negativă (-1)․
Nucleul atomului este centrul atomului și conține protoni și neutroni․ Nucleul este extrem de dens, conținând aproape toată masa atomului, deși ocupă o mică parte din volumul total․ Nucleul este ținut la un loc de forța nucleară puternică, care este o forță fundamentală a naturii, mult mai puternică decât forța electrostatică de respingere dintre protoni․
Atomul este unitatea fundamentală a materiei, cea mai mică particulă care păstrează proprietățile chimice ale unui element․ Este o structură complexă, formată din particule subatomice, care se află în continuă mișcare․ Atomii sunt atât de mici încât nu pot fi observați cu ochiul liber, ci doar cu ajutorul unor instrumente sofisticate, cum ar fi microscopul electronic․
Atomii sunt formați din trei tipuri de particule subatomice⁚ protoni, neutroni și electroni․ Protoni și neutroni se găsesc în nucleul atomului, care este centrul atomului și ocupă o mică parte din volumul total al atomului․ Electronii se rotesc în jurul nucleului, formând un nor electronic․ Protonii au o sarcină electrică pozitivă (+1), neutronii sunt neutri din punct de vedere electric, iar electronii au o sarcină electrică negativă (-1)․
Nucleul atomului este centrul atomului și conține protoni și neutroni․ Nucleul este extrem de dens, conținând aproape toată masa atomului, deși ocupă o mică parte din volumul total․ Nucleul este ținut la un loc de forța nucleară puternică, care este o forță fundamentală a naturii, mult mai puternică decât forța electrostatică de respingere dintre protoni;
Numărul atomic al unui element este egal cu numărul de protoni din nucleul atomului․ De exemplu, atomul de carbon are 6 protoni, deci numărul său atomic este 6․ Masa atomică a unui element este suma numărului de protoni și neutroni din nucleul atomului․ Masa atomică se exprimă în unități de masă atomică (u․a․m․)․ Masa unui proton este aproximativ 1 u․a․m․, iar masa unui neutron este de asemenea aproximativ 1 u․a․m․
Introducere în Structura Atomică
1․1 Atomul⁚ Blocul de Construcție al Materiei
Atomul este unitatea fundamentală a materiei, cea mai mică particulă care păstrează proprietățile chimice ale unui element․ Este o structură complexă, formată din particule subatomice, care se află în continuă mișcare․ Atomii sunt atât de mici încât nu pot fi observați cu ochiul liber, ci doar cu ajutorul unor instrumente sofisticate, cum ar fi microscopul electronic․
1․2 Subparticulele Atomice⁚ Protoni, Neutroni și Electroni
Atomii sunt formați din trei tipuri de particule subatomice⁚ protoni, neutroni și electroni․ Protoni și neutroni se găsesc în nucleul atomului, care este centrul atomului și ocupă o mică parte din volumul total al atomului․ Electronii se rotesc în jurul nucleului, formând un nor electronic․ Protonii au o sarcină electrică pozitivă (+1), neutronii sunt neutri din punct de vedere electric, iar electronii au o sarcină electrică negativă (-1)․
1․3 Nucleul Atomic⁚ Centrul Atomului
Nucleul atomului este centrul atomului și conține protoni și neutroni․ Nucleul este extrem de dens, conținând aproape toată masa atomului, deși ocupă o mică parte din volumul total․ Nucleul este ținut la un loc de forța nucleară puternică, care este o forță fundamentală a naturii, mult mai puternică decât forța electrostatică de respingere dintre protoni․
1․4 Numărul Atomic și Masa Atomică
Numărul atomic al unui element este egal cu numărul de protoni din nucleul atomului․ De exemplu, atomul de carbon are 6 protoni, deci numărul său atomic este 6․ Masa atomică a unui element este suma numărului de protoni și neutroni din nucleul atomului․ Masa atomică se exprimă în unități de masă atomică (u․a․m․)․ Masa unui proton este aproximativ 1 u․a․m․, iar masa unui neutron este de asemenea aproximativ 1 u․a․m․
1․5 Izotopii⁚ Același Element, Diferite Mase
Izotopii sunt atomi ai aceluiași element care au același număr de protoni, dar un număr diferit de neutroni․ Aceasta înseamnă că izotopii au același număr atomic, dar mase atomice diferite․ De exemplu, carbonul are doi izotopi comuni⁚ carbon-12 ($^{12}C$) și carbon-14 ($^{14}C$)․ Ambele izotopi au 6 protoni, dar carbon-12 are 6 neutroni, iar carbon-14 are 8 neutroni․ Izotopii au proprietăți chimice similare, dar proprietăți fizice ușor diferite, cum ar fi masa și radioactivitatea․
Modelele atomice au evoluat de-a lungul timpului, reflectând progresele înțelegerii structurii atomului․
2․1 Modelul Atomic al lui Rutherford
Modelul atomic al lui Rutherford, propus în 1911, a revoluționat înțelegerea structurii atomului․ Bazându-se pe experimentul său cu folia de aur, Rutherford a concluzionat că atomul are un nucleu mic, dens și pozitiv încărcat, înconjurat de electroni cu sarcină negativă care se mișcă pe orbite circulare․ Acest model a fost un pas important în direcția unei reprezentări mai precise a atomului, dar avea limitări, cum ar fi imposibilitatea de a explica stabilitatea atomului și spectrul liniar al atomilor․
2․2 Modelul Atomic al lui Bohr
Modelul atomic al lui Bohr, propus în 1913, a fost o îmbunătățire semnificativă a modelului lui Rutherford․ Bohr a introdus conceptul de nivele de energie cuantificate, postulând că electronii se mișcă pe orbite circulare specifice în jurul nucleului, fiecare orbită având o energie definită․ Tranzițiile electronilor între aceste nivele de energie explică emisia și absorbția de lumină de către atomi․ Modelul lui Bohr a reușit să explice spectrul de emisie al atomului de hidrogen, dar nu a putut explica spectrul atomilor mai complecși․
Modele Atomice
2․3 Modelul Atomic Cuantic
Modelul atomic cuantic, dezvoltat în secolul XX, este cel mai precis model al atomului․ Acesta se bazează pe principiile mecanicii cuantice, care descriu comportamentul particulelor la nivel atomic․ Modelul cuantic prezintă electronii ca unde de probabilitate, descrise de funcții de undă, care determină probabilitatea de a găsi un electron într-un anumit punct din spațiu․ Acest model explică o gamă largă de fenomene atomice, inclusiv spectrul atomilor, legăturile chimice și proprietățile chimice ale elementelor․
Proprietățile atomilor determină comportamentul lor în reacțiile chimice․
3․1 Configurația Electronică⁚ Aranjarea Electronilor
Configurația electronică a unui atom descrie modul în care electronii sunt aranjați în jurul nucleului․ Această aranjare este guvernată de principiul lui Aufbau, care prevede că electronii ocupă mai întâi nivelurile de energie mai joase․ De exemplu, atomul de hidrogen ($H$) are un singur electron, care ocupă orbitalul 1s․ Atomul de carbon ($C$) are șase electroni, cu configurația electronică 1s22s22p2․ Configurația electronică determină proprietățile chimice ale unui atom, inclusiv capacitatea sa de a forma legături chimice․
3․2 Electronii de Valență⁚ Rolul în Legăturile Chimice
Electronii de valență sunt electronii din ultimul strat electronic al unui atom, cei care participă la formarea legăturilor chimice․ De exemplu, atomul de oxigen ($O$) are șase electroni, dintre care doi sunt electroni de valență în stratul 2p․ Numărul electronilor de valență determină capacitatea unui atom de a forma legături chimice, influențând astfel reactivitatea chimică a elementului․ Legăturile chimice sunt formate prin partajarea sau transferul de electroni de valență între atomi․
3․3 Legăturile Chimice⁚ Ținând Atomii Împreună
Legăturile chimice sunt forțele atractive care țin atomii împreună în molecule și compuși․ Aceste legături se formează datorită interacțiunii dintre electronii de valență ai atomilor․ Există diferite tipuri de legături chimice, fiecare cu caracteristici specifice․ De exemplu, legăturile covalente se formează prin partajarea de electroni între atomi, în timp ce legăturile ionice se formează prin transferul de electroni de la un atom la altul․ Legăturile chimice sunt esențiale pentru existența moleculelor și compușilor, determinând proprietățile chimice și fizice ale substanțelor․
Proprietățile Atomilor
3․4 Tipuri de Legături Chimice⁚ Covalente, Ionice și de Hidrogen
Legăturile covalente, formate prin partajarea de electroni între atomi, sunt comune în moleculele organice, cum ar fi apa ($H_2O$) și dioxidul de carbon ($CO_2$)․ Legăturile ionice, care implică transferul de electroni de la un atom la altul, formează compuși ionici, cum ar fi clorura de sodiu ($NaCl$)․ Legăturile de hidrogen, mai slabe decât cele covalente și ionice, se formează între un atom de hidrogen legat covalent la un atom electronegativ, cum ar fi oxigenul sau azotul, și un atom electronegativ din altă moleculă․
Materia poate exista în patru stări de agregare⁚ solidă, lichidă, gazoasă și plasmatică․
4․1 Solide, Lichide și Gaze
Solidele au o formă și un volum definite, datorită aranjării ordonate a atomilor lor․ Lichidele au un volum definit, dar își adaptează forma la recipientul în care se află, având o mobilitate mai mare a atomilor․ Gazele nu au o formă sau un volum definit, atomii lor mișcându-se liber și independent․
4․2 Plasma⁚ A Patra Stare de Agregare
Plasma este o stare a materiei în care atomii sunt ionizați, adică au pierdut sau câștigat electroni, formând ioni liberi․ Această stare este caracterizată de o conductivitate electrică ridicată și de o sensibilitate puternică la câmpurile magnetice․ Plasma se găsește în stele, fulgere și lămpi fluorescente․
Stările de Agregare ale Materiei
4․3 Tranzițiile de Fază⁚ Schimbări de Stare
Tranzițiile de fază reprezintă schimbările de stare a materiei․ De exemplu, topirea este tranziția de la solid la lichid, iar evaporarea este tranziția de la lichid la gaz․ Aceste tranziții sunt determinate de variația temperaturii și presiunii․ Alte tranziții de fază includ sublimarea (solid la gaz), depunerea (gaz la solid) și condensarea (gaz la lichid)․
Reacțiile chimice implică rearanjarea atomilor și moleculelor, rezultând formarea de noi substanțe․
5․1 Reacții Chimice⁚ Schimbări în Compoziția Substanțelor
Reacțiile chimice implică rearanjarea atomilor și moleculelor, rezultând formarea de noi substanțe; De exemplu, arderea lemnului este o reacție chimică în care atomii de carbon, hidrogen și oxigen din lemn se combină cu oxigenul din aer pentru a forma dioxid de carbon, apă și cenușă․ Această reacție este însoțită de eliberarea de energie sub formă de căldură și lumină․
5․2 Tipuri de Reacții Chimice⁚ Reacții de Combinare, Descompunere, Deplasare și Dublă Deplasare
Reacțiile chimice se clasifică în funcție de tipul de transformare chimică care are loc․ Reacțiile de combinare implică unirea a două sau mai multe substanțe pentru a forma o singură substanță․ Reacțiile de descompunere sunt inversele reacțiilor de combinare, o singură substanță se descompune în două sau mai multe substanțe․ Reacțiile de deplasare implică înlocuirea unui element dintr-un compus cu alt element․ Reacțiile de dublă deplasare implică schimbul de ioni între două compuși․
5․3 Echilibrul Chimic⁚ Un Stat de Echilibru Dinamic
Echilibrul chimic este o stare în care viteza reacției directe este egală cu viteza reacției inverse․ În această stare, concentrațiile reactanților și produșilor rămân constante în timp․ Echilibrul chimic este un echilibru dinamic, deoarece reacțiile directe și inverse continuă să aibă loc, dar la viteze egale․ Echilibrul chimic este un concept important în chimie, deoarece permite prezicerea direcției și gradului de reacție․
Reacții Chimice
5․4 Cinetica Chimică⁚ Viteza Reacțiilor Chimice
Cinetica chimică studiază viteza reacțiilor chimice și factorii care o influențează․ Viteza unei reacții chimice este determinată de o serie de factori, inclusiv concentrația reactanților, temperatura, suprafața de contact, prezența catalizatorilor și energia de activare․ Cunoașterea cineticii chimice este esențială pentru optimizarea proceselor industriale, controlul reacțiilor chimice și înțelegerea mecanismelor reacțiilor․
Chimia organică se concentrează pe studiul compușilor care conțin carbon, cum ar fi metanul ($CH_4$) și etanolul ($C_2H_5OH$)․
6․1 Hidrocarburile⁚ Baza Chimiei Organice
Hidrocarburile sunt compuși organici care conțin doar atomi de carbon și hidrogen․ Exemple de hidrocarburi includ metanul ($CH_4$), etanul ($C_2H_6$) și benzenul ($C_6H_6$)․ Metanul, cel mai simplu alcan, este un gaz incolor și inodor, folosit ca combustibil․ Etanul, un alt alcan, este un gaz incolor și inodor, folosit ca materie primă în producția de plastic․ Benzenul, un hidrocarbur aromatic, este un lichid incolor cu un miros dulceag, folosit ca solvent și în sinteza altor compuși organici․ Aceste exemple ilustrează diversitatea și importanța hidrocarburilor în chimia organică․
6․2 Grupele Funcționale⁚ Influența asupra Proprietăților
Grupele funcționale sunt atomi sau grupuri de atomi care conferă moleculelor organice proprietăți specifice․ De exemplu, grupa hidroxil (-OH) este prezentă în alcooli, conferindu-le proprietăți polare și puncte de fierbere mai ridicate comparativ cu alcanii cu același număr de atomi de carbon․ Grupa carboxil (-COOH) este prezentă în acizii carboxilici, conferindu-le proprietăți acide․ Grupele funcționale joacă un rol crucial în determinarea reactivității și a proprietăților fizice și chimice ale moleculelor organice;
Chimia Organică
6․3 Polimerii⁚ Lanțuri Lungi de Monomeri
Polimerii sunt molecule mari formate din unități repetitive mai mici numite monomeri․ De exemplu, polietilena este un polimer format din unități repetitive de etilenă ($CH_2=CH_2$)․ Polimerii pot fi naturali, cum ar fi proteinele și ADN-ul, sau sintetici, cum ar fi plasticul și cauciucul․ Proprietățile polimerilor depind de tipul de monomeri, de lungimea lanțului polimeric și de modul în care lanțurile sunt legate între ele․
Biochimia se concentrează pe chimia proceselor vitale, incluzând molecule organice precum proteinele, lipidele și acizii nucleici․
7․1 Carbohidrații⁚ Sursa Principală de Energie
Carbohidrații sunt compuși organici formați din carbon, hidrogen și oxigen, cu formula generală $C_n(H_2O)_m$․ Exemple de carbohidrați includ glucoza ($C_6H_{12}O_6$), un zahăr simplu, și amidonul, un polimer complex de glucoză․ Glucoza este o sursă primară de energie pentru celulele vii, în timp ce amidonul este o formă de stocare a energiei în plante․
7․2 Lipidele⁚ Grăsimi și Uleiuri
Lipidele sunt o clasă diversă de molecule organice insolubile în apă, care includ grăsimi, uleiuri, steroizi și fosfolipide․ Grăsimile și uleiurile sunt formate din glicerol și acizi grași, care sunt lanțuri lungi de hidrocarburi․ Exemple de grăsimi includ untul și untura, în timp ce exemple de uleiuri includ uleiul de măsline și uleiul de floarea-soarelui․ Lipidele joacă un rol important în stocarea energiei, izolarea termică și formarea membranelor celulare․
7․3 Proteinele⁚ Blocurile de Construcție ale Vieții
Proteinele sunt macromolecule complexe formate din lanțuri lungi de aminoacizi․ Există 20 de aminoacizi diferiți care pot fi combinați în diverse secvențe pentru a forma o varietate uriașă de proteine․ Proteinele joacă roluri esențiale în organism, inclusiv catalizarea reacțiilor chimice, transportul moleculelor, susținerea structurii celulare și apărarea împotriva agenților patogeni․ Exemple de proteine includ hemoglobina, care transportă oxigenul în sânge, și insulina, care reglează nivelul zahărului din sânge․
Biochimia⁚ Chimia Vieții
7․4 Acizii Nucleici⁚ Depozitarii Informației Genetice
Acizii nucleici, ADN (acid dezoxiribonucleic) și ARN (acid ribonucleic), sunt macromolecule complexe care stochează și transmit informația genetică․ ADN-ul este o moleculă dublu-catenară care conține codul genetic al unui organism, în timp ce ARN-ul este o moleculă monocatenară care joacă un rol important în sinteza proteinelor․ Acizii nucleici sunt formați din nucleotide, care sunt compuse dintr-o bază azotată, o pentoză și un grup fosfat․ Exemple de nucleotide includ adenina (A), guanina (G), citozina (C) și timina (T) în ADN, și uracilul (U) în ARN․
Concluzie
Înțelegerea atomilor este esențială pentru a explica proprietățile materiei și a dezvolta noi tehnologii․