Formula chimică a etanolului

Etanolul, un alcool simplu cu o gamă largă de aplicații, este un compus organic cu o formulă chimică specifică care definește compoziția sa.
Etanolul, cunoscut și sub numele de alcool etilic, este un compus organic cu o importanță semnificativă în diverse domenii, de la industria chimică la medicina și biotehnologie. Este un alcool primar, caracterizat prin prezența unei grupe hidroxil (-OH) legate de un atom de carbon primar. Formula chimică a etanolului, care definește compoziția sa elementară, este crucială pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă.
Formula chimică a etanolului poate fi exprimată în două moduri principale⁚ formula moleculară și formula empirică. Formula moleculară prezintă numărul exact de atomi din fiecare element prezent în moleculă, în timp ce formula empirică indică doar raportul dintre atomii elementelor din moleculă.
În această analiză detaliată, vom explora formula moleculară și formula empirică a etanolului, dezvăluind astfel compoziția sa elementară și oferind o bază solidă pentru înțelegerea proprietăților și reacțiilor acestui compus organic important.
Etanolul, cunoscut și sub numele de alcool etilic, este un compus organic cu o importanță semnificativă în diverse domenii, de la industria chimică la medicina și biotehnologie. Este un alcool primar, caracterizat prin prezența unei grupe hidroxil (-OH) legate de un atom de carbon primar. Formula chimică a etanolului, care definește compoziția sa elementară, este crucială pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă.
Formula chimică a etanolului poate fi exprimată în două moduri principale⁚ formula moleculară și formula empirică. Formula moleculară prezintă numărul exact de atomi din fiecare element prezent în moleculă, în timp ce formula empirică indică doar raportul dintre atomii elementelor din moleculă.
În această analiză detaliată, vom explora formula moleculară și formula empirică a etanolului, dezvăluind astfel compoziția sa elementară și oferind o bază solidă pentru înțelegerea proprietăților și reacțiilor acestui compus organic important.
Formula moleculară a etanolului este (C_2H_6O). Această formulă indică faptul că o moleculă de etanol conține doi atomi de carbon, șase atomi de hidrogen și un atom de oxigen. Formula moleculară oferă informații complete despre compoziția elementară a moleculei, incluzând numărul exact de atomi din fiecare element.
Formula moleculară este esențială pentru calcularea masei moleculare a etanolului, care este de 46,07 g/mol. Masa moleculară este suma maselor atomice ale tuturor atomilor din moleculă. În cazul etanolului, masa moleculară se calculează ca⁚ (2 x 12,01 g/mol) + (6 x 1,01 g/mol) + (1 x 16,00 g/mol) = 46,07 g/mol.
Formula moleculară a etanolului este o reprezentare importantă a compoziției sale, oferind o bază solidă pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă.
Etanolul, cunoscut și sub numele de alcool etilic, este un compus organic cu o importanță semnificativă în diverse domenii, de la industria chimică la medicina și biotehnologie. Este un alcool primar, caracterizat prin prezența unei grupe hidroxil (-OH) legate de un atom de carbon primar. Formula chimică a etanolului, care definește compoziția sa elementară, este crucială pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă.
Formula chimică a etanolului poate fi exprimată în două moduri principale⁚ formula moleculară și formula empirică. Formula moleculară prezintă numărul exact de atomi din fiecare element prezent în moleculă, în timp ce formula empirică indică doar raportul dintre atomii elementelor din moleculă.
În această analiză detaliată, vom explora formula moleculară și formula empirică a etanolului, dezvăluind astfel compoziția sa elementară și oferind o bază solidă pentru înțelegerea proprietăților și reacțiilor acestui compus organic important.
Formula moleculară a etanolului este (C_2H_6O). Această formulă indică faptul că o moleculă de etanol conține doi atomi de carbon, șase atomi de hidrogen și un atom de oxigen. Formula moleculară oferă informații complete despre compoziția elementară a moleculei, incluzând numărul exact de atomi din fiecare element.
Formula moleculară este esențială pentru calcularea masei moleculare a etanolului, care este de 46,07 g/mol. Masa moleculară este suma maselor atomice ale tuturor atomilor din moleculă. În cazul etanolului, masa moleculară se calculează ca⁚ (2 x 12,01 g/mol) + (6 x 1,01 g/mol) + (1 x 16,00 g/mol) = 46,07 g/mol.
Formula moleculară a etanolului este o reprezentare importantă a compoziției sale, oferind o bază solidă pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă.
Formula empirică a etanolului este (CH_3O). Această formulă indică raportul cel mai simplu dintre atomii de carbon, hidrogen și oxigen din moleculă. Formula empirică nu oferă informații complete despre numărul exact de atomi din fiecare element, ci doar despre raportul dintre ei.
Formula empirică este utilă pentru determinarea compoziției elementare a unui compus necunoscut, dar nu oferă informații despre structura sa moleculară. De exemplu, formula empirică (CH_2O) poate reprezenta atât formaldehida (HCHO), cât și acidul formic (HCOOH).
În cazul etanolului, formula empirică (CH_3O) ne spune că pentru fiecare atom de carbon există trei atomi de hidrogen și un atom de oxigen. Această informație este utilă pentru a înțelege raportul dintre elementele din moleculă, dar nu oferă informații despre numărul exact de atomi din fiecare element.
Formula empirică a etanolului este utilă în anumite contexte, dar formula moleculară oferă o reprezentare mai completă a compoziției sale elementare.
Etanolul, cunoscut și sub numele de alcool etilic, este un compus organic cu o importanță semnificativă în diverse domenii, de la industria chimică la medicina și biotehnologie. Este un alcool primar, caracterizat prin prezența unei grupe hidroxil (-OH) legate de un atom de carbon primar. Formula chimică a etanolului, care definește compoziția sa elementară, este crucială pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă.
Formula chimică a etanolului poate fi exprimată în două moduri principale⁚ formula moleculară și formula empirică. Formula moleculară prezintă numărul exact de atomi din fiecare element prezent în moleculă, în timp ce formula empirică indică doar raportul dintre atomii elementelor din moleculă.
În această analiză detaliată, vom explora formula moleculară și formula empirică a etanolului, dezvăluind astfel compoziția sa elementară și oferind o bază solidă pentru înțelegerea proprietăților și reacțiilor acestui compus organic important.
Formula moleculară a etanolului este (C_2H_6O). Această formulă indică faptul că o moleculă de etanol conține doi atomi de carbon, șase atomi de hidrogen și un atom de oxigen. Formula moleculară oferă informații complete despre compoziția elementară a moleculei, incluzând numărul exact de atomi din fiecare element.
Formula moleculară este esențială pentru calcularea masei moleculare a etanolului, care este de 46,07 g/mol. Masa moleculară este suma maselor atomice ale tuturor atomilor din moleculă. În cazul etanolului, masa moleculară se calculează ca⁚ (2 x 12,01 g/mol) + (6 x 1,01 g/mol) + (1 x 16,00 g/mol) = 46,07 g/mol.
Formula moleculară a etanolului este o reprezentare importantă a compoziției sale, oferind o bază solidă pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă.
Formula empirică a etanolului este (CH_3O). Această formulă indică raportul cel mai simplu dintre atomii de carbon, hidrogen și oxigen din moleculă. Formula empirică nu oferă informații complete despre numărul exact de atomi din fiecare element, ci doar despre raportul dintre ei.
Formula empirică este utilă pentru determinarea compoziției elementare a unui compus necunoscut, dar nu oferă informații despre structura sa moleculară. De exemplu, formula empirică (CH_2O) poate reprezenta atât formaldehida (HCHO), cât și acidul formic (HCOOH).
În cazul etanolului, formula empirică (CH_3O) ne spune că pentru fiecare atom de carbon există trei atomi de hidrogen și un atom de oxigen. Această informație este utilă pentru a înțelege raportul dintre elementele din moleculă, dar nu oferă informații despre numărul exact de atomi din fiecare element;
Formula empirică a etanolului este utilă în anumite contexte, dar formula moleculară oferă o reprezentare mai completă a compoziției sale elementare.
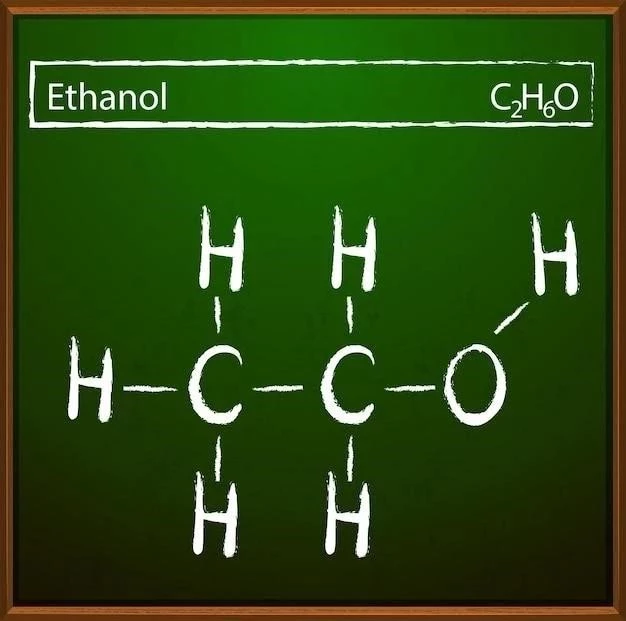
Structura chimică a etanolului este la fel de importantă ca și formula sa chimică, deoarece determină proprietățile sale chimice și fizice. Structura etanolului poate fi reprezentată în diverse moduri, inclusiv prin formule structurale și modele 3D.
Formula structurală a etanolului arată aranjamentul atomilor și legăturilor chimice din moleculă. Formula structurală a etanolului este⁚ CH_3CH_2OH. Această formulă arată că molecula de etanol este formată dintr-un lanț de doi atomi de carbon, la care este legat un grup hidroxil (-OH).
Modelele 3D ale etanolului oferă o reprezentare mai realistă a structurii sale, arătând aranjamentul spațial al atomilor și legăturilor chimice. Aceste modele arată că molecula de etanol are o formă tridimensională, cu un unghi de legătură specific între atomii de carbon, hidrogen și oxigen.
Structura chimică a etanolului este crucială pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă. De exemplu, prezența grupei hidroxil (-OH) conferă etanolului proprietăți polare, ceea ce explică solubilitatea sa în apă.
Etanolul, cunoscut și sub numele de alcool etilic, este un compus organic cu o importanță semnificativă în diverse domenii, de la industria chimică la medicina și biotehnologie. Este un alcool primar, caracterizat prin prezența unei grupe hidroxil (-OH) legate de un atom de carbon primar. Formula chimică a etanolului, care definește compoziția sa elementară, este crucială pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă.
Formula chimică a etanolului poate fi exprimată în două moduri principale⁚ formula moleculară și formula empirică. Formula moleculară prezintă numărul exact de atomi din fiecare element prezent în moleculă, în timp ce formula empirică indică doar raportul dintre atomii elementelor din moleculă.
În această analiză detaliată, vom explora formula moleculară și formula empirică a etanolului, dezvăluind astfel compoziția sa elementară și oferind o bază solidă pentru înțelegerea proprietăților și reacțiilor acestui compus organic important.
Formula moleculară a etanolului este (C_2H_6O). Această formulă indică faptul că o moleculă de etanol conține doi atomi de carbon, șase atomi de hidrogen și un atom de oxigen. Formula moleculară oferă informații complete despre compoziția elementară a moleculei, incluzând numărul exact de atomi din fiecare element.
Formula moleculară este esențială pentru calcularea masei moleculare a etanolului, care este de 46,07 g/mol. Masa moleculară este suma maselor atomice ale tuturor atomilor din moleculă. În cazul etanolului, masa moleculară se calculează ca⁚ (2 x 12,01 g/mol) + (6 x 1,01 g/mol) + (1 x 16,00 g/mol) = 46,07 g/mol.
Formula moleculară a etanolului este o reprezentare importantă a compoziției sale, oferind o bază solidă pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă;
Formula empirică a etanolului este (CH_3O). Această formulă indică raportul cel mai simplu dintre atomii de carbon, hidrogen și oxigen din moleculă. Formula empirică nu oferă informații complete despre numărul exact de atomi din fiecare element, ci doar despre raportul dintre ei.
Formula empirică este utilă pentru determinarea compoziției elementare a unui compus necunoscut, dar nu oferă informații despre structura sa moleculară. De exemplu, formula empirică (CH_2O) poate reprezenta atât formaldehida (HCHO), cât și acidul formic (HCOOH).
În cazul etanolului, formula empirică (CH_3O) ne spune că pentru fiecare atom de carbon există trei atomi de hidrogen și un atom de oxigen. Această informație este utilă pentru a înțelege raportul dintre elementele din moleculă, dar nu oferă informații despre numărul exact de atomi din fiecare element.
Formula empirică a etanolului este utilă în anumite contexte, dar formula moleculară oferă o reprezentare mai completă a compoziției sale elementare.
Structura chimică a etanolului este la fel de importantă ca și formula sa chimică, deoarece determină proprietățile sale chimice și fizice. Structura etanolului poate fi reprezentată în diverse moduri, inclusiv prin formule structurale și modele 3D.
Formula structurală a etanolului arată aranjamentul atomilor și legăturilor chimice din moleculă. Formula structurală a etanolului este⁚ CH_3CH_2OH. Această formulă arată că molecula de etanol este formată dintr-un lanț de doi atomi de carbon, la care este legat un grup hidroxil (-OH).
Modelele 3D ale etanolului oferă o reprezentare mai realistă a structurii sale, arătând aranjamentul spațial al atomilor și legăturilor chimice. Aceste modele arată că molecula de etanol are o formă tridimensională, cu un unghi de legătură specific între atomii de carbon, hidrogen și oxigen.
Structura chimică a etanolului este crucială pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă. De exemplu, prezența grupei hidroxil (-OH) conferă etanolului proprietăți polare, ceea ce explică solubilitatea sa în apă.
Reprezentarea Structurii Lewis
Reprezentarea Structurii Lewis a etanolului este o diagramă simplă care arată aranjamentul atomilor și electronilor de valență în moleculă. Această reprezentare este utilă pentru a vizualiza legăturile chimice și perechile de electroni neparticipanți în moleculă.
În reprezentarea Structurii Lewis a etanolului, atomii de carbon sunt legați covalent de atomii de hidrogen și de oxigen. Fiecare atom de carbon are patru electroni de valență, iar fiecare atom de hidrogen are un electron de valență. Atomul de oxigen are șase electroni de valență.
În reprezentarea Structurii Lewis, legăturile chimice sunt reprezentate prin linii, iar perechile de electroni neparticipanți sunt reprezentate prin puncte. Structura Lewis a etanolului arată că atomii de carbon sunt legați de atomii de hidrogen prin legături simple, iar atomul de oxigen este legat de un atom de carbon printr-o legătură simplă și de un atom de hidrogen printr-o legătură simplă.
Reprezentarea Structurii Lewis a etanolului este o reprezentare simplă, dar utilă, care ne ajută să înțelegem aranjamentul atomilor și electronilor de valență în moleculă.
Etanolul, cunoscut și sub numele de alcool etilic, este un compus organic cu o importanță semnificativă în diverse domenii, de la industria chimică la medicina și biotehnologie. Este un alcool primar, caracterizat prin prezența unei grupe hidroxil (-OH) legate de un atom de carbon primar. Formula chimică a etanolului, care definește compoziția sa elementară, este crucială pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă.
Formula chimică a etanolului poate fi exprimată în două moduri principale⁚ formula moleculară și formula empirică. Formula moleculară prezintă numărul exact de atomi din fiecare element prezent în moleculă, în timp ce formula empirică indică doar raportul dintre atomii elementelor din moleculă.
În această analiză detaliată, vom explora formula moleculară și formula empirică a etanolului, dezvăluind astfel compoziția sa elementară și oferind o bază solidă pentru înțelegerea proprietăților și reacțiilor acestui compus organic important.
Formula moleculară a etanolului este (C_2H_6O). Această formulă indică faptul că o moleculă de etanol conține doi atomi de carbon, șase atomi de hidrogen și un atom de oxigen. Formula moleculară oferă informații complete despre compoziția elementară a moleculei, incluzând numărul exact de atomi din fiecare element.
Formula moleculară este esențială pentru calcularea masei moleculare a etanolului, care este de 46,07 g/mol. Masa moleculară este suma maselor atomice ale tuturor atomilor din moleculă. În cazul etanolului, masa moleculară se calculează ca⁚ (2 x 12,01 g/mol) + (6 x 1,01 g/mol) + (1 x 16,00 g/mol) = 46,07 g/mol.
Formula moleculară a etanolului este o reprezentare importantă a compoziției sale, oferind o bază solidă pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă.
Formula empirică a etanolului este (CH_3O). Această formulă indică raportul cel mai simplu dintre atomii de carbon, hidrogen și oxigen din moleculă. Formula empirică nu oferă informații complete despre numărul exact de atomi din fiecare element, ci doar despre raportul dintre ei.
Formula empirică este utilă pentru determinarea compoziției elementare a unui compus necunoscut, dar nu oferă informații despre structura sa moleculară. De exemplu, formula empirică (CH_2O) poate reprezenta atât formaldehida (HCHO), cât și acidul formic (HCOOH).
În cazul etanolului, formula empirică (CH_3O) ne spune că pentru fiecare atom de carbon există trei atomi de hidrogen și un atom de oxigen. Această informație este utilă pentru a înțelege raportul dintre elementele din moleculă, dar nu oferă informații despre numărul exact de atomi din fiecare element.
Formula empirică a etanolului este utilă în anumite contexte, dar formula moleculară oferă o reprezentare mai completă a compoziției sale elementare.
Structura chimică a etanolului este la fel de importantă ca și formula sa chimică, deoarece determină proprietățile sale chimice și fizice. Structura etanolului poate fi reprezentată în diverse moduri, inclusiv prin formule structurale și modele 3D.
Formula structurală a etanolului arată aranjamentul atomilor și legăturilor chimice din moleculă. Formula structurală a etanolului este⁚ CH_3CH_2OH. Această formulă arată că molecula de etanol este formată dintr-un lanț de doi atomi de carbon, la care este legat un grup hidroxil (-OH).
Modelele 3D ale etanolului oferă o reprezentare mai realistă a structurii sale, arătând aranjamentul spațial al atomilor și legăturilor chimice. Aceste modele arată că molecula de etanol are o formă tridimensională, cu un unghi de legătură specific între atomii de carbon, hidrogen și oxigen.
Structura chimică a etanolului este crucială pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă. De exemplu, prezența grupei hidroxil (-OH) conferă etanolului proprietăți polare, ceea ce explică solubilitatea sa în apă.
Reprezentarea Structurii Lewis
Reprezentarea Structurii Lewis a etanolului este o diagramă simplă care arată aranjamentul atomilor și electronilor de valență în moleculă. Această reprezentare este utilă pentru a vizualiza legăturile chimice și perechile de electroni neparticipanți în moleculă.
În reprezentarea Structurii Lewis a etanolului, atomii de carbon sunt legați covalent de atomii de hidrogen și de oxigen. Fiecare atom de carbon are patru electroni de valență, iar fiecare atom de hidrogen are un electron de valență. Atomul de oxigen are șase electroni de valență.
În reprezentarea Structurii Lewis, legăturile chimice sunt reprezentate prin linii, iar perechile de electroni neparticipanți sunt reprezentate prin puncte. Structura Lewis a etanolului arată că atomii de carbon sunt legați de atomii de hidrogen prin legături simple, iar atomul de oxigen este legat de un atom de carbon printr-o legătură simplă și de un atom de hidrogen printr-o legătură simplă.
Reprezentarea Structurii Lewis a etanolului este o reprezentare simplă, dar utilă, care ne ajută să înțelegem aranjamentul atomilor și electronilor de valență în moleculă.
Reprezentarea Structurii 3D
Reprezentarea 3D a etanolului oferă o perspectivă mai realistă asupra structurii sale moleculare, arătând aranjamentul spațial al atomilor și unghiurile de legătură. Această reprezentare este esențială pentru a înțelege proprietățile chimice și fizice ale etanolului, cum ar fi polaritatea, solubilitatea și punctul de fierbere.
În reprezentarea 3D, molecula de etanol este prezentată ca o structură tridimensională, cu atomii de carbon, hidrogen și oxigen aranjați într-un mod specific. Unghiurile de legătură dintre atomi sunt determinate de repulsia dintre perechile de electroni din legăturile chimice.
Reprezentarea 3D a etanolului ne arată că molecula are o formă asimetrică, cu un grup hidroxil (-OH) legat de un atom de carbon primar. Această asimetrie este responsabilă pentru proprietățile polare ale etanolului, care îl fac solubil în apă.
Reprezentarea 3D a etanolului este un instrument important pentru vizualizarea structurii sale moleculare și pentru înțelegerea proprietăților sale chimice și fizice.
Formula Chimică a Etanolului⁚ O Analiză Detaliată
Introducere
Etanolul, cunoscut și sub numele de alcool etilic, este un compus organic cu o importanță semnificativă în diverse domenii, de la industria chimică la medicina și biotehnologie. Este un alcool primar, caracterizat prin prezența unei grupe hidroxil (-OH) legate de un atom de carbon primar. Formula chimică a etanolului, care definește compoziția sa elementară, este crucială pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă.
Formula chimică a etanolului poate fi exprimată în două moduri principale⁚ formula moleculară și formula empirică. Formula moleculară prezintă numărul exact de atomi din fiecare element prezent în moleculă, în timp ce formula empirică indică doar raportul dintre atomii elementelor din moleculă.
În această analiză detaliată, vom explora formula moleculară și formula empirică a etanolului, dezvăluind astfel compoziția sa elementară și oferind o bază solidă pentru înțelegerea proprietăților și reacțiilor acestui compus organic important.
Formula Moleculară a Etanolului
Formula moleculară a etanolului este (C_2H_6O). Această formulă indică faptul că o moleculă de etanol conține doi atomi de carbon, șase atomi de hidrogen și un atom de oxigen. Formula moleculară oferă informații complete despre compoziția elementară a moleculei, incluzând numărul exact de atomi din fiecare element.
Formula moleculară este esențială pentru calcularea masei moleculare a etanolului, care este de 46,07 g/mol. Masa moleculară este suma maselor atomice ale tuturor atomilor din moleculă. În cazul etanolului, masa moleculară se calculează ca⁚ (2 x 12,01 g/mol) + (6 x 1,01 g/mol) + (1 x 16,00 g/mol) = 46,07 g/mol.
Formula moleculară a etanolului este o reprezentare importantă a compoziției sale, oferind o bază solidă pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă.
Formula Empirică a Etanolului
Formula empirică a etanolului este (CH_3O). Această formulă indică raportul cel mai simplu dintre atomii de carbon, hidrogen și oxigen din moleculă. Formula empirică nu oferă informații complete despre numărul exact de atomi din fiecare element, ci doar despre raportul dintre ei.
Formula empirică este utilă pentru determinarea compoziției elementare a unui compus necunoscut, dar nu oferă informații despre structura sa moleculară. De exemplu, formula empirică (CH_2O) poate reprezenta atât formaldehida (HCHO), cât și acidul formic (HCOOH).
În cazul etanolului, formula empirică (CH_3O) ne spune că pentru fiecare atom de carbon există trei atomi de hidrogen și un atom de oxigen. Această informație este utilă pentru a înțelege raportul dintre elementele din moleculă, dar nu oferă informații despre numărul exact de atomi din fiecare element.
Formula empirică a etanolului este utilă în anumite contexte, dar formula moleculară oferă o reprezentare mai completă a compoziției sale elementare.
Structura Chimică a Etanolului
Structura chimică a etanolului este la fel de importantă ca și formula sa chimică, deoarece determină proprietățile sale chimice și fizice. Structura etanolului poate fi reprezentată în diverse moduri, inclusiv prin formule structurale și modele 3D.
Formula structurală a etanolului arată aranjamentul atomilor și legăturilor chimice din moleculă. Formula structurală a etanolului este⁚ CH_3CH_2OH; Această formulă arată că molecula de etanol este formată dintr-un lanț de doi atomi de carbon, la care este legat un grup hidroxil (-OH).
Modelele 3D ale etanolului oferă o reprezentare mai realistă a structurii sale, arătând aranjamentul spațial al atomilor și legăturilor chimice. Aceste modele arată că molecula de etanol are o formă tridimensională, cu un unghi de legătură specific între atomii de carbon, hidrogen și oxigen.
Structura chimică a etanolului este crucială pentru înțelegerea proprietăților sale chimice și fizice, precum și a reacțiilor în care participă. De exemplu, prezența grupei hidroxil (-OH) conferă etanolului proprietăți polare, ceea ce explică solubilitatea sa în apă.
Reprezentarea Structurii Lewis
Reprezentarea Structurii Lewis a etanolului este o diagramă simplă care arată aranjamentul atomilor și electronilor de valență în moleculă. Această reprezentare este utilă pentru a vizualiza legăturile chimice și perechile de electroni neparticipanți în moleculă.
În reprezentarea Structurii Lewis a etanolului, atomii de carbon sunt legați covalent de atomii de hidrogen și de oxigen. Fiecare atom de carbon are patru electroni de valență, iar fiecare atom de hidrogen are un electron de valență. Atomul de oxigen are șase electroni de valență.
În reprezentarea Structurii Lewis, legăturile chimice sunt reprezentate prin linii, iar perechile de electroni neparticipanți sunt reprezentate prin puncte. Structura Lewis a etanolului arată că atomii de carbon sunt legați de atomii de hidrogen prin legături simple, iar atomul de oxigen este legat de un atom de carbon printr-o legătură simplă și de un atom de hidrogen printr-o legătură simplă.
Reprezentarea Structurii Lewis a etanolului este o reprezentare simplă, dar utilă, care ne ajută să înțelegem aranjamentul atomilor și electronilor de valență în moleculă.
Reprezentarea Structurii 3D
Reprezentarea 3D a etanolului oferă o perspectivă mai realistă asupra structurii sale moleculare, arătând aranjamentul spațial al atomilor și unghiurile de legătură. Această reprezentare este esențială pentru a înțelege proprietățile chimice și fizice ale etanolului, cum ar fi polaritatea, solubilitatea și punctul de fierbere.
În reprezentarea 3D, molecula de etanol este prezentată ca o structură tridimensională, cu atomii de carbon, hidrogen și oxigen aranjați într-un mod specific. Unghiurile de legătură dintre atomi sunt determinate de repulsia dintre perechile de electroni din legăturile chimice.
Reprezentarea 3D a etanolului ne arată că molecula are o formă asimetrică, cu un grup hidroxil (-OH) legat de un atom de carbon primar. Această asimetrie este responsabilă pentru proprietățile polare ale etanolului, care îl fac solubil în apă.
Reprezentarea 3D a etanolului este un instrument important pentru vizualizarea structurii sale moleculare și pentru înțelegerea proprietăților sale chimice și fizice.
Proprietățile Chimice ale Etanolului
Proprietățile chimice ale etanolului sunt determinate de prezența grupei hidroxil (-OH), care este grupa funcțională caracteristică alcoolilor. Grupa hidroxil conferă etanolului proprietăți polare și îl face capabil să participe la diverse reacții chimice.
Etanolul este un compus relativ reactiv, capabil să participe la diverse reacții chimice, inclusiv reacții de oxidare, esterificare, dehidratare și reacții de substituție. Reactivitatea etanolului este influențată de prezența grupei hidroxil (-OH), care poate fi ușor protonată sau deprotonată în funcție de condițiile de reacție.
Proprietățile chimice ale etanolului îl fac un compus versatil cu o gamă largă de aplicații, inclusiv ca solvent, combustibil și materie primă pentru sinteza altor compuși organici.
Articolul este bine documentat și oferă o prezentare completă a formulelor chimice ale etanolului. Utilizarea terminologiei specifice este adecvată și contribuie la o mai bună înțelegere a subiectului. Recomand adăugarea unor diagrame sau ilustrații pentru a vizualiza mai bine structura moleculei de etanol.
Articolul este bine scris și oferă o prezentare clară și concisă a formulelor chimice ale etanolului. Apreciez utilizarea terminologiei specifice și explicațiile detaliate. Ar fi util să se adauge o secțiune dedicată metodelor de producere a etanolului.
Articolul prezintă o introducere convingătoare a etanolului, evidențiind importanța sa în diverse domenii. Explicația formulelor chimice este detaliată și ușor de înțeles. Ar fi util să se includă o secțiune dedicată utilizărilor etanolului în diverse industrii.
Apreciez claritatea și precizia cu care este prezentată informația. Explicația formulelor chimice este convingătoare și contribuie la o mai bună înțelegere a compoziției etanolului. Ar fi utilă adăugarea unor exemple practice pentru a ilustra aplicațiile etanolului.
Articolul este bine scris și oferă o prezentare clară și concisă a formulelor chimice ale etanolului. Apreciez utilizarea terminologiei specifice și explicațiile detaliate. Ar fi util să se adauge o secțiune dedicată impactului etanolului asupra mediului.
Articolul este bine organizat și ușor de citit. Explicația formulelor chimice este clară și concisă. Ar fi benefic să se includă o secțiune dedicată proprietăților fizice și chimice ale etanolului, pentru a completa informația prezentată.
Articolul este bine documentat și oferă o prezentare completă a formulelor chimice ale etanolului. Explicația este clară și concisă, facilitând înțelegerea subiectului. Ar fi util să se includă o secțiune dedicată reacțiilor chimice în care participă etanolul.
Articolul este bine organizat și ușor de citit. Explicația formulelor chimice este clară și concisă. Ar fi benefic să se includă o secțiune dedicată aspectelor de siguranță legate de manipularea etanolului.
Articolul prezintă o introducere clară și concisă a etanolului, evidențiind importanța sa în diverse domenii. Explicația formulelor chimice este bine structurată și ușor de înțeles, oferind o bază solidă pentru înțelegerea compoziției etanolului.