Configurația electronică și tabelul periodic

Introducere
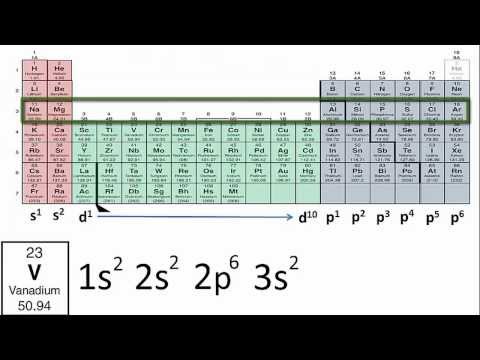
Tabelul periodic al elementelor este o hartă organizată a tuturor elementelor chimice cunoscute, aranjate în funcție de numărul atomic și proprietățile lor chimice․ Configurația electronică a unui atom descrie modul în care electronii sunt aranjați în jurul nucleului, oferind o perspectivă fundamentală asupra comportamentului chimic al elementului․
Tabelul periodic și configurația electronică
Tabelul periodic al elementelor este o reprezentare vizuală a ordinii elementelor chimice, organizate în funcție de numărul lor atomic crescător․ Această organizare reflectă o periodicitate remarcabilă a proprietăților chimice, care este strâns legată de configurația electronică a atomilor․ Configurația electronică a unui element descrie distribuția electronilor în jurul nucleului atomic, specificând nivelurile de energie și orbitalii pe care aceștia îi ocupă․
Configurația electronică este esențială pentru înțelegerea comportamentului chimic al elementelor․ De exemplu, numărul de electroni de valență, adică electronii din ultimul nivel de energie, determină capacitatea unui element de a forma legături chimice․ Tabelul periodic reflectă această legătură între configurația electronică și proprietățile chimice․ Elementele din aceeași coloană, numite grupuri, au configurații electronice similare în ultimul nivel de energie, ceea ce explică proprietățile lor chimice asemănătoare․
Prin urmare, tabelul periodic, împreună cu configurația electronică, oferă un cadru esențial pentru înțelegerea chimiei, permițând predicția și explicarea comportamentului chimic al elementelor․
Importanța configurației electronice
Configurația electronică a unui atom este un concept central în chimie, oferind o perspectivă fundamentală asupra comportamentului chimic al elementelor․ Această configurație descrie modul în care electronii sunt aranjați în jurul nucleului atomic, specificând nivelurile de energie și orbitalii pe care aceștia îi ocupă․ Înțelegerea configurației electronice este esențială pentru a explica și prezice o gamă largă de fenomene chimice, inclusiv formarea legăturilor chimice, reactivitatea chimică și proprietățile fizice ale elementelor․
Configurația electronică ne permite să înțelegem de ce elementele din aceeași coloană a tabelului periodic au proprietăți chimice similare․ De exemplu, elementele din grupa 1, metalele alcaline, au toate un singur electron de valență, ceea ce le conferă o reactivitate ridicată․ Configurația electronică ne ajută, de asemenea, să explicăm tendințele periodice, cum ar fi variația energiei de ionizare și a electronegativității de-a lungul tabelului periodic․
În concluzie, configurația electronică este un instrument esențial pentru înțelegerea chimiei, oferind o bază pentru predicția și explicarea comportamentului chimic al elementelor․
Fundamentele configurației electronice
Pentru a înțelege configurația electronică, este esențial să explorăm structura atomică, numerele cuantice și orbitalii atomici․
Structura atomică
Atomul, unitatea fundamentală a materiei, este compus dintr-un nucleu dens, încărcat pozitiv, format din protoni și neutroni, înconjurat de un nor de electroni cu sarcină negativă․ Numărul de protoni din nucleu, numit număr atomic (Z), definește identitatea elementului chimic․ De exemplu, atomul de hidrogen (H) are un singur proton (Z = 1), în timp ce atomul de carbon (C) are șase protoni (Z = 6)․ Electronii, cu sarcină negativă, orbitează nucleul la diferite distanțe și energii, formând straturi electronice․ Fiecare strat electronic este caracterizat de un nivel de energie specific, iar electronii din straturile exterioare sunt cei care participă la formarea legăturilor chimice, determinând astfel proprietățile chimice ale elementului․
Numerele cuantice
Pentru a descrie complet starea unui electron într-un atom, se utilizează patru numere cuantice⁚ numărul cuantic principal (n), numărul cuantic azimutal sau al momentului unghiular (l), numărul cuantic magnetic (ml) și numărul cuantic de spin (ms)․ Numărul cuantic principal (n) descrie nivelul de energie al electronului, luând valori întregi pozitive (n = 1, 2, 3, ․․;), cu valori mai mari corespunzând nivelurilor de energie mai ridicate․ Numărul cuantic azimutal (l) descrie forma orbitalului atomic și poate lua valori de la 0 la n-1․ l = 0 corespunde unui orbital s, l = 1 corespunde unui orbital p, l = 2 corespunde unui orbital d, iar l = 3 corespunde unui orbital f․ Numărul cuantic magnetic (ml) descrie orientarea orbitalului în spațiu și poate lua valori de la -l la +l, inclusiv 0․ De exemplu, pentru l = 1 (orbital p), ml poate lua valorile -1, 0, +1, corespunzând celor trei orbitali p (px, py, pz)․ Numărul cuantic de spin (ms) descrie momentul unghiular intrinsec al electronului, care este asociat cu rotația sa․ Electronii au un spin de 1/2, iar ms poate lua valorile +1/2 sau -1/2․
Orbitalii atomici
Orbitalii atomici sunt regiuni din spațiu în jurul nucleului atomic unde probabilitatea de a găsi un electron este maximă․ Forma și energia orbitalilor atomici sunt determinate de numerele cuantice․ Orbitalii s sunt sferici, cu o singură orientare spațială․ Orbitalii p au o formă de halteră, cu trei orientări spațiale (px, py, pz)․ Orbitalii d au forme mai complexe, cu cinci orientări spațiale․ Orbitalii f au forme și mai complexe, cu șapte orientări spațiale․ Fiecare orbital atomic poate găzdui maxim doi electroni, conform principiului excluderii Pauli, care afirmă că doi electroni dintr-un atom nu pot avea aceleași valori pentru toate cele patru numere cuantice․ Orbitalii atomici sunt organizați în niveluri de energie, cu orbitalii s având cea mai mică energie, urmat de orbitalii p, d și f․ În cadrul aceluiași nivel de energie, orbitalii s au cea mai mică energie, urmat de orbitalii p, d și f․
Configurația electronică a elementelor
Configurația electronică a unui atom descrie modul în care electronii sunt distribuiți în orbitalii atomici, respectând anumite reguli și principii․
Principiul Aufbau
Principiul Aufbau, cunoscut și sub numele de regula Aufbau, este o regulă fundamentală în chimie care ghidează ordinea umplerii orbitalilor atomici cu electroni․ Această regulă prevede că electronii sunt adăugați în orbitalii atomici în ordinea crescătoare a energiei lor, de la orbitalii cu energia cea mai mică la cei cu energia cea mai mare․
Orbitalii atomici sunt descriși prin numerele cuantice, care determină energia, forma și orientarea spațială a orbitalilor․ Orbitalii cu energie mai mică sunt umpluți mai întâi, iar electronii sunt adăugați în orbitalii cu energie mai mare numai după ce orbitalii cu energie mai mică sunt complet umpluți․
Ordinea de umplere a orbitalilor atomici este determinată de diagrama Aufbau, care prezintă o succesiune specifică a orbitalilor, ținând cont de energia lor relativă․ Această diagramă este un instrument esențial pentru înțelegerea configurației electronice a elementelor․
Regula lui Hund
Regula lui Hund, cunoscută și sub numele de regula maximului multiplicității, este o regulă importantă în chimie care descrie modul în care electronii sunt distribuiți în orbitalii atomici․ Această regulă prevede că electronii vor ocupa mai întâi fiecare orbital dintr-un subsol de energie cu un singur electron, cu spinul paralel, înainte de a începe să umple orbitalii cu doi electroni․
Această regulă este o consecință a repulsiei interelectronice․ Electronii cu spin paralel se resping mai puțin decât electronii cu spin antiparalel, deoarece au o distribuție spațială diferită․ Prin urmare, este mai favorabil energetic ca electronii să ocupe orbitali separați cu spin paralel, minimizând repulsia electrostatică․
Regula lui Hund este esențială pentru determinarea configurației electronice a elementelor și pentru a explica proprietățile lor chimice, cum ar fi magnetismul․ De exemplu, atomii cu electroni nepereche în orbitali atomici sunt paramagnetici, adică sunt atrași de un câmp magnetic extern․
Exemplu de configurație electronică
Să luăm ca exemplu atomul de azot (N), care are numărul atomic 7․ Conform principiului Aufbau, electronii sunt adăugați în ordinea crescătoare a energiei nivelurilor de energie․ Configurația electronică a azotului este⁚
$1s^2 2s^2 2p^3$
Această configurație poate fi interpretată astfel⁚
- Nivelul de energie 1 are doi electroni în orbitalul 1s․
- Nivelul de energie 2 are doi electroni în orbitalul 2s și trei electroni în orbitalul 2p․
Conform regulii lui Hund, cei trei electroni din orbitalul 2p ocupă separat fiecare dintre cei trei orbitali 2p, cu spin paralel․ Această configurație este mai stabilă decât o configurație în care doi electroni ar ocupa același orbital 2p, deoarece minimizează repulsia interelectronică․
Configurația electronică a azotului ne arată că are trei electroni nepereche, ceea ce explică proprietățile sale magnetice și reactivitatea chimică․
Proprietățile chimice și configurația electronică
Configurația electronică a unui atom joacă un rol crucial în determinarea proprietăților sale chimice, inclusiv valența, reactivitatea și tendințele periodice․
Valența și reactivitatea chimică
Valența unui element se referă la numărul de legături chimice pe care le poate forma un atom al acelui element․ Această valență este direct legată de configurația electronică, mai precis de numărul de electroni de valență, care sunt electronii din ultimul strat electronic al atomului․ Electronii de valență sunt cei care participă la formarea legăturilor chimice․ De exemplu, atomii de carbon au 4 electroni de valență, ceea ce explică de ce carbonul formează de obicei 4 legături covalente․ Reactivitatea chimică a unui element este o măsură a ușurinței cu care un atom al acelui element formează legături chimice cu alți atomi․ Elementele cu un număr mare de electroni de valență tind să fie mai reactive, deoarece pot forma mai multe legături․
Energia de ionizare și electronegativitatea
Energia de ionizare este energia necesară pentru a elimina un electron dintr-un atom gazos în starea sa fundamentală․ Această energie este direct legată de configurația electronică, deoarece electronii din straturile electronice exterioare, cu energie mai mare, sunt mai ușor de eliminat․ Un atom cu o energie de ionizare scăzută este mai predispus să își piardă electronii, formând cationi․ Electronegativitatea este o măsură a atracției unui atom pentru electronii dintr-o legătură chimică․ Elementele cu o electronegativitate ridicată au o tendință mai mare de a atrage electronii din legăturile cu atomii mai puțin electronegativi․ Configurația electronică influențează electronegativitatea, deoarece atomii cu electroni de valență mai puțini, care sunt atrași mai puternic de nucleu, au o electronegativitate mai mare․
Tendințele periodice
Configurația electronică explică tendințele periodice observate în tabelul periodic․ De exemplu, energia de ionizare crește de la stânga la dreapta într-o perioadă, deoarece numărul de protoni din nucleu crește, ceea ce atrage mai puternic electronii din straturile electronice exterioare․ În același timp, energia de ionizare scade de sus în jos într-o grupă, deoarece electronii de valență sunt mai departe de nucleu și sunt mai ușor de îndepărtat․ Electronegativitatea urmează o tendință similară⁚ crește de la stânga la dreapta și scade de sus în jos, reflectând atracția mai puternică a nucleului pentru electronii de valență în elementele din dreapta și din partea superioară a tabelului periodic․
Aplicații ale configurației electronice
Configurația electronică este un instrument esențial în chimia modernă, cu aplicații diverse în spectroscopie, modelarea legăturilor chimice și predicția proprietăților materialelor․
Spectroscopie
Spectroscopia este o tehnică care studiază interacțiunea dintre radiația electromagnetică și materie․ Configurația electronică joacă un rol crucial în înțelegerea spectrelor atomice și moleculare․ Atunci când un atom absoarbe energie, un electron poate fi excitat dintr-un nivel energetic inferior la unul superior․ Această tranziție este caracterizată de o anumită lungime de undă a radiației absorbite, care este unică pentru atomul respectiv․ Spectrul de absorbție rezultat este o amprentă digitală a configurației electronice a atomului, oferind informații despre nivelele de energie și structura electronică․
De exemplu, în spectroscopia de emisie atomică, atomii excitați emit fotoni la o anumită lungime de undă când se relaxează la starea fundamentală; Această radiație emisă poate fi analizată pentru a identifica atomii prezenți în probă și pentru a determina concentrația lor․ Spectroscopia de emisie atomică este utilizată pe scară largă în chimie analitică, pentru a determina compoziția elementelor din diverse probe, de la metale la soluții․
Modelarea legăturilor chimice
Configurația electronică este esențială pentru înțelegerea formării legăturilor chimice între atomi․ Legăturile chimice apar din interacțiunea electronilor de valență, cei situați în ultimul strat electronic al atomului․ Configurația electronică ne spune câți electroni de valență are un atom și cum aceștia sunt distribuiți în orbitali atomici․ Această informație ne permite să prezicem tipul de legătură chimică (covalentă, ionică, metalică) ce se va forma între atomi și geometria moleculelor rezultate․
De exemplu, atomii cu un număr mic de electroni de valență tind să formeze legături ionice, transferând electroni către atomi cu un număr mai mare de electroni de valență․ În schimb, atomii cu un număr intermediar de electroni de valență formează legături covalente, partajând electroni pentru a obține o configurație electronică stabilă․ Configurația electronică ne permite să înțelegem de ce unele elemente sunt mai reactive decât altele, de ce anumite molecule au o anumită formă geometrică și de ce anumite substanțe au proprietăți fizice și chimice specifice․
Concluzie
Configurația electronică este un instrument esențial pentru înțelegerea comportamentului chimic al elementelor și pentru prezicerea proprietăților compușilor․
Rezumând
Configurația electronică este un concept fundamental în chimie, oferind o bază pentru înțelegerea comportamentului chimic al elementelor․ Prin aranjarea electronilor în orbitali atomici, configurația electronică explică proprietățile chimice, cum ar fi valența, reactivitatea și tendințele periodice․ Utilizarea principiului Aufbau, a regulii lui Hund și a numerelor cuantice permite predicția configurației electronice a atomilor․ Configurația electronică este esențială pentru modelarea legăturilor chimice, interpretarea spectrelor atomice și pentru prezicerea proprietăților compușilor․
Aplicații viitoare
Înțelegerea configurației electronice continuă să joace un rol crucial în avansarea științei materialelor, a nanotehnologiei și a chimiei computaționale․ Dezvoltarea de noi materiale cu proprietăți specifice, cum ar fi conductivitatea electrică sau proprietățile optice, se bazează pe o înțelegere profundă a configurației electronice a atomilor care compun materialul․ De asemenea, modelarea computațională a reacțiilor chimice, inclusiv predicția reacțiilor chimice și a catalizei, se bazează pe principiile configurației electronice․ Cercetările viitoare în domeniul configurației electronice se vor concentra pe o mai bună înțelegere a comportamentului electronilor în sisteme complexe, cum ar fi moleculele organice și materialele nanostructurate, deschizând noi căi pentru descoperirea și sinteza de noi materiale și tehnologii․
Articolul este scris într-un stil clar și concis, făcând din el o resursă utilă pentru înțelegerea configurației electronice. Aș sugera adăugarea unor exemple practice de configurații electronice pentru elemente specifice, pentru a consolida înțelegerea cititorului.
Articolul este bine documentat și oferă o prezentare cuprinzătoare a configurației electronice. Aș sugera adăugarea unor informații suplimentare despre excepțiile de la regula lui Hund și principiul lui Aufbau, pentru a oferi o imagine mai completă a configurației electronice.
Articolul oferă o prezentare excelentă a configurației electronice și a importanței sale în chimie. Aș sugera adăugarea unor informații despre aplicațiile practice ale configurației electronice, cum ar fi în spectroscopie și în studiul reacțiilor chimice.
Articolul prezintă o perspectivă valoroasă asupra configurației electronice și rolului său în chimie. Aș sugera adăugarea unor referințe bibliografice pentru a sprijini afirmațiile prezentate și a oferi cititorului posibilitatea de a aprofunda subiectul.
Articolul este bine structurat și prezintă o analiză detaliată a relației dintre configurația electronică și proprietățile chimice ale elementelor. Aș sugera adăugarea unor diagrame sau ilustrații pentru a vizualiza mai bine conceptul de orbitali atomici și configurația electronică a atomilor.
Articolul prezintă o introducere clară și concisă a conceptului de configurație electronică și a legăturii sale cu tabelul periodic al elementelor. Explicația este ușor de înțeles, iar exemplele furnizate ajută la o mai bună înțelegere a subiectului. Recomand adăugarea unor detalii suplimentare despre regulile de umplere a orbitalilor, precum regula lui Hund și principiul lui Aufbau, pentru a oferi o imagine mai completă a configurației electronice.
Articolul este scris într-un stil clar și accesibil, făcând din el o resursă utilă pentru înțelegerea configurației electronice. Aș aprecia adăugarea unor exerciții practice la finalul articolului, pentru a testa înțelegerea cititorului și a consolida cunoștințele dobândite.
Articolul oferă o prezentare convingătoare a importanței configurației electronice în chimie. Apreciez modul clar și concis în care autorul explică legătura dintre configurația electronică și comportamentul chimic al elementelor. Aș sugera extinderea discuției cu exemple concrete de reacții chimice și cum configurația electronică influențează formarea legăturilor chimice.
Articolul este bine structurat și prezintă o analiză detaliată a relației dintre configurația electronică și proprietățile chimice ale elementelor. Aș sugera adăugarea unor informații suplimentare despre legătura dintre configurația electronică și proprietățile fizice ale elementelor, cum ar fi punctul de topire și punctul de fierbere.