De ce este tabelul periodic colorat?
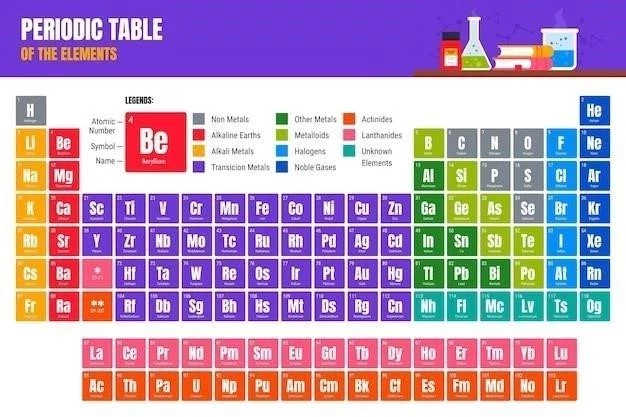

De ce este tabelul periodic colorat?
Tabelul periodic al elementelor este un instrument esențial în chimie, oferind o clasificare sistematică a tuturor elementelor cunoscute.
De ce este tabelul periodic colorat?
Tabelul periodic al elementelor este un instrument esențial în chimie, oferind o clasificare sistematică a tuturor elementelor cunoscute. Arată o dispunere logică a elementelor, bazată pe proprietățile lor chimice și fizice, facilitând înțelegerea comportamentului lor. O caracteristică distinctivă a tabelului periodic este utilizarea codării colorate, o tehnică vizuală care ajută la identificarea rapidă a elementelor cu proprietăți similare. Această colorare nu este aleatorie, ci reflectă o organizare profundă a elementelor în funcție de structura lor electronică și proprietățile lor chimice.
De ce este tabelul periodic colorat?
Tabelul periodic al elementelor este un instrument esențial în chimie, oferind o clasificare sistematică a tuturor elementelor cunoscute. Arată o dispunere logică a elementelor, bazată pe proprietățile lor chimice și fizice, facilitând înțelegerea comportamentului lor. O caracteristică distinctivă a tabelului periodic este utilizarea codării colorate, o tehnică vizuală care ajută la identificarea rapidă a elementelor cu proprietăți similare. Această colorare nu este aleatorie, ci reflectă o organizare profundă a elementelor în funcție de structura lor electronică și proprietățile lor chimice.
Tabelul periodic este un instrument indispensabil în chimie, oferind o reprezentare vizuală a relațiilor dintre elemente. Această reprezentare facilitează înțelegerea proprietăților elementelor, a reacțiilor chimice și a legăturilor chimice. De asemenea, tabelul periodic permite predicția comportamentului elementelor necunoscute, bazându-se pe tendințele observate în cadrul grupelor și perioadelor. Importanța sa transcende domeniul chimiei, fiind esențială în domenii precum fizica, biologia și medicina.
De ce este tabelul periodic colorat?
Tabelul periodic al elementelor este un instrument esențial în chimie, oferind o clasificare sistematică a tuturor elementelor cunoscute. Arată o dispunere logică a elementelor, bazată pe proprietățile lor chimice și fizice, facilitând înțelegerea comportamentului lor. O caracteristică distinctivă a tabelului periodic este utilizarea codării colorate, o tehnică vizuală care ajută la identificarea rapidă a elementelor cu proprietăți similare. Această colorare nu este aleatorie, ci reflectă o organizare profundă a elementelor în funcție de structura lor electronică și proprietățile lor chimice.
Tabelul periodic este un instrument indispensabil în chimie, oferind o reprezentare vizuală a relațiilor dintre elemente. Această reprezentare facilitează înțelegerea proprietăților elementelor, a reacțiilor chimice și a legăturilor chimice. De asemenea, tabelul periodic permite predicția comportamentului elementelor necunoscute, bazându-se pe tendințele observate în cadrul grupelor și perioadelor. Importanța sa transcende domeniul chimiei, fiind esențială în domenii precum fizica, biologia și medicina.
Organizarea tabelului periodic se bazează pe numărul atomic al elementelor, care reprezintă numărul de protoni din nucleul atomului. Elementele sunt aranjate în ordinea crescătoare a numărului atomic, formând șapte rânduri orizontale, numite perioade, și 18 coloane verticale, numite grupe. Elementele din aceeași perioadă au același număr de straturi electronice, iar elementele din aceeași grupă au același număr de electroni de valență, ceea ce explică similaritatea proprietăților lor chimice.
De ce este tabelul periodic colorat?
Tabelul periodic al elementelor este un instrument esențial în chimie, oferind o clasificare sistematică a tuturor elementelor cunoscute. Arată o dispunere logică a elementelor, bazată pe proprietățile lor chimice și fizice, facilitând înțelegerea comportamentului lor. O caracteristică distinctivă a tabelului periodic este utilizarea codării colorate, o tehnică vizuală care ajută la identificarea rapidă a elementelor cu proprietăți similare. Această colorare nu este aleatorie, ci reflectă o organizare profundă a elementelor în funcție de structura lor electronică și proprietățile lor chimice.
Tabelul periodic este un instrument indispensabil în chimie, oferind o reprezentare vizuală a relațiilor dintre elemente. Această reprezentare facilitează înțelegerea proprietăților elementelor, a reacțiilor chimice și a legăturilor chimice. De asemenea, tabelul periodic permite predicția comportamentului elementelor necunoscute, bazându-se pe tendințele observate în cadrul grupelor și perioadelor. Importanța sa transcende domeniul chimiei, fiind esențială în domenii precum fizica, biologia și medicina.
Organizarea tabelului periodic se bazează pe numărul atomic al elementelor, care reprezintă numărul de protoni din nucleul atomului. Elementele sunt aranjate în ordinea crescătoare a numărului atomic, formând șapte rânduri orizontale, numite perioade, și 18 coloane verticale, numite grupe. Elementele din aceeași perioadă au același număr de straturi electronice, iar elementele din aceeași grupă au același număr de electroni de valență, ceea ce explică similaritatea proprietăților lor chimice.
Grupe și perioade
Tabelul periodic este organizat în 18 coloane verticale, numite grupe, și 7 rânduri orizontale, numite perioade. Elementele din aceeași grupă au proprietăți chimice similare, deoarece au același număr de electroni de valență, adică electronii din ultimul strat electronic. De exemplu, elementele din grupa 1 (metalele alcaline) au un singur electron de valență, ceea ce le conferă o reactivitate ridicată. Elementele din aceeași perioadă au același număr de straturi electronice, dar numărul de electroni de valență variază, ceea ce determină o variație a proprietăților lor chimice.
De ce este tabelul periodic colorat?
Tabelul periodic al elementelor este un instrument esențial în chimie, oferind o clasificare sistematică a tuturor elementelor cunoscute. Arată o dispunere logică a elementelor, bazată pe proprietățile lor chimice și fizice, facilitând înțelegerea comportamentului lor. O caracteristică distinctivă a tabelului periodic este utilizarea codării colorate, o tehnică vizuală care ajută la identificarea rapidă a elementelor cu proprietăți similare. Această colorare nu este aleatorie, ci reflectă o organizare profundă a elementelor în funcție de structura lor electronică și proprietățile lor chimice.
Tabelul periodic este un instrument indispensabil în chimie, oferind o reprezentare vizuală a relațiilor dintre elemente. Această reprezentare facilitează înțelegerea proprietăților elementelor, a reacțiilor chimice și a legăturilor chimice. De asemenea, tabelul periodic permite predicția comportamentului elementelor necunoscute, bazându-se pe tendințele observate în cadrul grupelor și perioadelor. Importanța sa transcende domeniul chimiei, fiind esențială în domenii precum fizica, biologia și medicina.
Organizarea tabelului periodic se bazează pe numărul atomic al elementelor, care reprezintă numărul de protoni din nucleul atomului. Elementele sunt aranjate în ordinea crescătoare a numărului atomic, formând șapte rânduri orizontale, numite perioade, și 18 coloane verticale, numite grupe. Elementele din aceeași perioadă au același număr de straturi electronice, iar elementele din aceeași grupă au același număr de electroni de valență, ceea ce explică similaritatea proprietăților lor chimice.
Grupe și perioade
Tabelul periodic este organizat în 18 coloane verticale, numite grupe, și 7 rânduri orizontale, numite perioade. Elementele din aceeași grupă au proprietăți chimice similare, deoarece au același număr de electroni de valență, adică electronii din ultimul strat electronic. De exemplu, elementele din grupa 1 (metalele alcaline) au un singur electron de valență, ceea ce le conferă o reactivitate ridicată. Elementele din aceeași perioadă au același număr de straturi electronice, dar numărul de electroni de valență variază, ceea ce determină o variație a proprietăților lor chimice.
Număr atomic și masă atomică
Fiecare element din tabelul periodic este identificat printr-un număr atomic ($Z$) și o masă atomică ($A$). Numărul atomic reprezintă numărul de protoni din nucleul atomului, iar masa atomică reprezintă suma maselor protonilor și neutronilor din nucleu. Numărul atomic este un număr întreg, specific fiecărui element, și determină poziția sa în tabelul periodic. Masa atomică poate fi un număr fracționar, deoarece reflectă media maselor izotopilor unui element.
De ce este tabelul periodic colorat?
Tabelul periodic al elementelor este un instrument esențial în chimie, oferind o clasificare sistematică a tuturor elementelor cunoscute. Arată o dispunere logică a elementelor, bazată pe proprietățile lor chimice și fizice, facilitând înțelegerea comportamentului lor. O caracteristică distinctivă a tabelului periodic este utilizarea codării colorate, o tehnică vizuală care ajută la identificarea rapidă a elementelor cu proprietăți similare. Această colorare nu este aleatorie, ci reflectă o organizare profundă a elementelor în funcție de structura lor electronică și proprietățile lor chimice.
Tabelul periodic este un instrument indispensabil în chimie, oferind o reprezentare vizuală a relațiilor dintre elemente. Această reprezentare facilitează înțelegerea proprietăților elementelor, a reacțiilor chimice și a legăturilor chimice. De asemenea, tabelul periodic permite predicția comportamentului elementelor necunoscute, bazându-se pe tendințele observate în cadrul grupelor și perioadelor. Importanța sa transcende domeniul chimiei, fiind esențială în domenii precum fizica, biologia și medicina.
Organizarea tabelului periodic se bazează pe numărul atomic al elementelor, care reprezintă numărul de protoni din nucleul atomului. Elementele sunt aranjate în ordinea crescătoare a numărului atomic, formând șapte rânduri orizontale, numite perioade, și 18 coloane verticale, numite grupe. Elementele din aceeași perioadă au același număr de straturi electronice, iar elementele din aceeași grupă au același număr de electroni de valență, ceea ce explică similaritatea proprietăților lor chimice.
Grupe și perioade
Tabelul periodic este organizat în 18 coloane verticale, numite grupe, și 7 rânduri orizontale, numite perioade. Elementele din aceeași grupă au proprietăți chimice similare, deoarece au același număr de electroni de valență, adică electronii din ultimul strat electronic. De exemplu, elementele din grupa 1 (metalele alcaline) au un singur electron de valență, ceea ce le conferă o reactivitate ridicată. Elementele din aceeași perioadă au același număr de straturi electronice, dar numărul de electroni de valență variază, ceea ce determină o variație a proprietăților lor chimice.
Număr atomic și masă atomică
Fiecare element din tabelul periodic este identificat printr-un număr atomic ($Z$) și o masă atomică ($A$). Numărul atomic reprezintă numărul de protoni din nucleul atomului, iar masa atomică reprezintă suma maselor protonilor și neutronilor din nucleu. Numărul atomic este un număr întreg, specific fiecărui element, și determină poziția sa în tabelul periodic. Masa atomică poate fi un număr fracționar, deoarece reflectă media maselor izotopilor unui element.
Proprietățile chimice ale elementelor sunt determinate de configurația electronică a atomilor lor, adică de modul în care electronii sunt aranjați în jurul nucleului; Această configurație electronică influențează tendința atomilor de a forma legături chimice, de a câștiga sau pierde electroni și de a participa la reacții chimice.
De ce este tabelul periodic colorat?
Tabelul periodic al elementelor este un instrument esențial în chimie, oferind o clasificare sistematică a tuturor elementelor cunoscute. Arată o dispunere logică a elementelor, bazată pe proprietățile lor chimice și fizice, facilitând înțelegerea comportamentului lor. O caracteristică distinctivă a tabelului periodic este utilizarea codării colorate, o tehnică vizuală care ajută la identificarea rapidă a elementelor cu proprietăți similare. Această colorare nu este aleatorie, ci reflectă o organizare profundă a elementelor în funcție de structura lor electronică și proprietățile lor chimice.
Tabelul periodic este un instrument indispensabil în chimie, oferind o reprezentare vizuală a relațiilor dintre elemente. Această reprezentare facilitează înțelegerea proprietăților elementelor, a reacțiilor chimice și a legăturilor chimice. De asemenea, tabelul periodic permite predicția comportamentului elementelor necunoscute, bazându-se pe tendințele observate în cadrul grupelor și perioadelor. Importanța sa transcende domeniul chimiei, fiind esențială în domenii precum fizica, biologia și medicina.
Organizarea tabelului periodic se bazează pe numărul atomic al elementelor, care reprezintă numărul de protoni din nucleul atomului. Elementele sunt aranjate în ordinea crescătoare a numărului atomic, formând șapte rânduri orizontale, numite perioade, și 18 coloane verticale, numite grupe. Elementele din aceeași perioadă au același număr de straturi electronice, iar elementele din aceeași grupă au același număr de electroni de valență, ceea ce explică similaritatea proprietăților lor chimice.
Grupe și perioade
Tabelul periodic este organizat în 18 coloane verticale, numite grupe, și 7 rânduri orizontale, numite perioade. Elementele din aceeași grupă au proprietăți chimice similare, deoarece au același număr de electroni de valență, adică electronii din ultimul strat electronic. De exemplu, elementele din grupa 1 (metalele alcaline) au un singur electron de valență, ceea ce le conferă o reactivitate ridicată. Elementele din aceeași perioadă au același număr de straturi electronice, dar numărul de electroni de valență variază, ceea ce determină o variație a proprietăților lor chimice.
Număr atomic și masă atomică
Fiecare element din tabelul periodic este identificat printr-un număr atomic ($Z$) și o masă atomică ($A$). Numărul atomic reprezintă numărul de protoni din nucleul atomului, iar masa atomică reprezintă suma maselor protonilor și neutronilor din nucleu. Numărul atomic este un număr întreg, specific fiecărui element, și determină poziția sa în tabelul periodic. Masa atomică poate fi un număr fracționar, deoarece reflectă media maselor izotopilor unui element.
Proprietățile chimice ale elementelor sunt determinate de configurația electronică a atomilor lor, adică de modul în care electronii sunt aranjați în jurul nucleului. Această configurație electronică influențează tendința atomilor de a forma legături chimice, de a câștiga sau pierde electroni și de a participa la reacții chimice.
Electronegativitatea
Electronegativitatea este o măsură a capacității unui atom de a atrage electroni într-o legătură chimică. Cu cât un atom este mai electronegativ, cu atât are o tendință mai mare de a atrage electroni spre el. Electronegativitatea crește de-a lungul unei perioade și scade în josul unei grupe. Elementele din partea dreaptă sus a tabelului periodic au valori mari ale electronegativității, în timp ce metalele din partea stângă jos au valori mici. Electronegativitatea este un factor important în determinarea tipului de legătură chimică care se formează între atomi.
De ce este tabelul periodic colorat?
Tabelul periodic al elementelor este un instrument esențial în chimie, oferind o clasificare sistematică a tuturor elementelor cunoscute. Arată o dispunere logică a elementelor, bazată pe proprietățile lor chimice și fizice, facilitând înțelegerea comportamentului lor. O caracteristică distinctivă a tabelului periodic este utilizarea codării colorate, o tehnică vizuală care ajută la identificarea rapidă a elementelor cu proprietăți similare. Această colorare nu este aleatorie, ci reflectă o organizare profundă a elementelor în funcție de structura lor electronică și proprietățile lor chimice.
Tabelul periodic este un instrument indispensabil în chimie, oferind o reprezentare vizuală a relațiilor dintre elemente. Această reprezentare facilitează înțelegerea proprietăților elementelor, a reacțiilor chimice și a legăturilor chimice. De asemenea, tabelul periodic permite predicția comportamentului elementelor necunoscute, bazându-se pe tendințele observate în cadrul grupelor și perioadelor. Importanța sa transcende domeniul chimiei, fiind esențială în domenii precum fizica, biologia și medicina.
Organizarea tabelului periodic se bazează pe numărul atomic al elementelor, care reprezintă numărul de protoni din nucleul atomului. Elementele sunt aranjate în ordinea crescătoare a numărului atomic, formând șapte rânduri orizontale, numite perioade, și 18 coloane verticale, numite grupe. Elementele din aceeași perioadă au același număr de straturi electronice, iar elementele din aceeași grupă au același număr de electroni de valență, ceea ce explică similaritatea proprietăților lor chimice.
Grupe și perioade
Tabelul periodic este organizat în 18 coloane verticale, numite grupe, și 7 rânduri orizontale, numite perioade. Elementele din aceeași grupă au proprietăți chimice similare, deoarece au același număr de electroni de valență, adică electronii din ultimul strat electronic. De exemplu, elementele din grupa 1 (metalele alcaline) au un singur electron de valență, ceea ce le conferă o reactivitate ridicată. Elementele din aceeași perioadă au același număr de straturi electronice, dar numărul de electroni de valență variază, ceea ce determină o variație a proprietăților lor chimice.
Număr atomic și masă atomică
Fiecare element din tabelul periodic este identificat printr-un număr atomic ($Z$) și o masă atomică ($A$). Numărul atomic reprezintă numărul de protoni din nucleul atomului, iar masa atomică reprezintă suma maselor protonilor și neutronilor din nucleu. Numărul atomic este un număr întreg, specific fiecărui element, și determină poziția sa în tabelul periodic. Masa atomică poate fi un număr fracționar, deoarece reflectă media maselor izotopilor unui element.
Proprietățile chimice ale elementelor sunt determinate de configurația electronică a atomilor lor, adică de modul în care electronii sunt aranjați în jurul nucleului. Această configurație electronică influențează tendința atomilor de a forma legături chimice, de a câștiga sau pierde electroni și de a participa la reacții chimice.
Electronegativitatea
Electronegativitatea este o măsură a capacității unui atom de a atrage electroni într-o legătură chimică. Cu cât un atom este mai electronegativ, cu atât are o tendință mai mare de a atrage electroni spre el. Electronegativitatea crește de-a lungul unei perioade și scade în josul unei grupe. Elementele din partea dreaptă sus a tabelului periodic au valori mari ale electronegativității, în timp ce metalele din partea stângă jos au valori mici. Electronegativitatea este un factor important în determinarea tipului de legătură chimică care se formează între atomi.
Energia de ionizare
Energia de ionizare este energia necesară pentru a elimina un electron dintr-un atom neutru în stare gazoasă, formând un ion pozitiv. Energia de ionizare este o măsură a tendinței unui atom de a pierde electroni. Cu cât energia de ionizare este mai mare, cu atât este mai dificil de îndepărtat un electron. Energia de ionizare crește de-a lungul unei perioade și scade în josul unei grupe. Elementele din partea dreaptă sus a tabelului periodic au valori mari ale energiei de ionizare, în timp ce metalele din partea stângă jos au valori mici. Energia de ionizare este un factor important în determinarea reactivității chimice a unui element.
De ce este tabelul periodic colorat?
Introducere
Tabelul periodic al elementelor este un instrument esențial în chimie, oferind o clasificare sistematică a tuturor elementelor cunoscute. Arată o dispunere logică a elementelor, bazată pe proprietățile lor chimice și fizice, facilitând înțelegerea comportamentului lor. O caracteristică distinctivă a tabelului periodic este utilizarea codării colorate, o tehnică vizuală care ajută la identificarea rapidă a elementelor cu proprietăți similare. Această colorare nu este aleatorie, ci reflectă o organizare profundă a elementelor în funcție de structura lor electronică și proprietățile lor chimice.
Importanța tabelului periodic
Tabelul periodic este un instrument indispensabil în chimie, oferind o reprezentare vizuală a relațiilor dintre elemente. Această reprezentare facilitează înțelegerea proprietăților elementelor, a reacțiilor chimice și a legăturilor chimice. De asemenea, tabelul periodic permite predicția comportamentului elementelor necunoscute, bazându-se pe tendințele observate în cadrul grupelor și perioadelor. Importanța sa transcende domeniul chimiei, fiind esențială în domenii precum fizica, biologia și medicina.
Organizarea tabelului periodic
Organizarea tabelului periodic se bazează pe numărul atomic al elementelor, care reprezintă numărul de protoni din nucleul atomului. Elementele sunt aranjate în ordinea crescătoare a numărului atomic, formând șapte rânduri orizontale, numite perioade, și 18 coloane verticale, numite grupe. Elementele din aceeași perioadă au același număr de straturi electronice, iar elementele din aceeași grupă au același număr de electroni de valență, ceea ce explică similaritatea proprietăților lor chimice.
Grupe și perioade
Tabelul periodic este organizat în 18 coloane verticale, numite grupe, și 7 rânduri orizontale, numite perioade. Elementele din aceeași grupă au proprietăți chimice similare, deoarece au același număr de electroni de valență, adică electronii din ultimul strat electronic. De exemplu, elementele din grupa 1 (metalele alcaline) au un singur electron de valență, ceea ce le conferă o reactivitate ridicată. Elementele din aceeași perioadă au același număr de straturi electronice, dar numărul de electroni de valență variază, ceea ce determină o variație a proprietăților lor chimice.
Număr atomic și masă atomică
Fiecare element din tabelul periodic este identificat printr-un număr atomic ($Z$) și o masă atomică ($A$). Numărul atomic reprezintă numărul de protoni din nucleul atomului, iar masa atomică reprezintă suma maselor protonilor și neutronilor din nucleu. Numărul atomic este un număr întreg, specific fiecărui element, și determină poziția sa în tabelul periodic. Masa atomică poate fi un număr fracționar, deoarece reflectă media maselor izotopilor unui element.
Proprietățile chimice ale elementelor
Proprietățile chimice ale elementelor sunt determinate de configurația electronică a atomilor lor, adică de modul în care electronii sunt aranjați în jurul nucleului. Această configurație electronică influențează tendința atomilor de a forma legături chimice, de a câștiga sau pierde electroni și de a participa la reacții chimice.
Electronegativitatea
Electronegativitatea este o măsură a capacității unui atom de a atrage electroni într-o legătură chimică. Cu cât un atom este mai electronegativ, cu atât are o tendință mai mare de a atrage electroni spre el. Electronegativitatea crește de-a lungul unei perioade și scade în josul unei grupe. Elementele din partea dreaptă sus a tabelului periodic au valori mari ale electronegativității, în timp ce metalele din partea stângă jos au valori mici. Electronegativitatea este un factor important în determinarea tipului de legătură chimică care se formează între atomi.
Energia de ionizare
Energia de ionizare este energia necesară pentru a elimina un electron dintr-un atom neutru în stare gazoasă, formând un ion pozitiv. Energia de ionizare este o măsură a tendinței unui atom de a pierde electroni. Cu cât energia de ionizare este mai mare, cu atât este mai dificil de îndepărtat un electron. Energia de ionizare crește de-a lungul unei perioade și scade în josul unei grupe. Elementele din partea dreaptă sus a tabelului periodic au valori mari ale energiei de ionizare, în timp ce metalele din partea stângă jos au valori mici. Energia de ionizare este un factor important în determinarea reactivității chimice a unui element.
Reactivitatea
Reactivitatea unui element se referă la tendința sa de a participa la reacții chimice. Reactivitatea este influențată de o serie de factori, inclusiv energia de ionizare, electronegativitatea și configurația electronică a atomilor. În general, elementele cu energii de ionizare scăzute și electronegativități scăzute sunt mai reactive. Metalele din partea stângă jos a tabelului periodic sunt cele mai reactive, în timp ce nemetalele din partea dreaptă sus sunt cele mai puțin reactive. Reactivitatea este un factor important în determinarea aplicațiilor practice ale elementelor.