Diagrame atomice și configurații electronice ale elementelor

Diagrame atomice⁚ Configurații electronice ale elementelor
Diagramele atomice‚ denumite și configurații electronice‚ oferă o reprezentare vizuală a modului în care electronii sunt aranjați în jurul nucleului unui atom․ Această reprezentare este esențială pentru înțelegerea proprietăților chimice ale elementelor și prezicerea modului în care acestea vor interacționa cu alte elemente․
Introducere
Configurațiile electronice ale elementelor sunt o reprezentare schematică a modului în care electronii sunt aranjați în jurul nucleului unui atom․ Această reprezentare este esențială pentru înțelegerea proprietăților chimice ale elementelor‚ cum ar fi reactivitatea‚ energia de ionizare‚ electronegativitatea și formarea legăturilor chimice․ Configurația electronică a unui atom descrie distribuția electronilor în diferite niveluri de energie și subniveluri‚ în conformitate cu principiile mecanicii cuantice․
Fiecare nivel de energie este caracterizat de un număr cuantic principal‚ $n$‚ care poate lua valori întregi pozitive‚ de la 1 la infinit․ Aceste niveluri de energie sunt împărțite în subniveluri‚ fiecare subnivel fiind caracterizat de un număr cuantic azimutal‚ $l$‚ care poate lua valori de la 0 la $n-1$․ Subnivelurile $l=0$‚ $l=1$‚ $l=2$‚ și $l=3$ sunt denumite $s$‚ $p$‚ $d$‚ și $f$‚ respectiv․ Fiecare subnivel conține un anumit număr de orbitali atomici‚ fiecare orbital atomic putând găzdui maxim doi electroni cu spinuri opuse․
Configurația electronică a unui atom este scrisă ca o succesiune de numere cuantice principale și subniveluri‚ urmate de numărul de electroni din fiecare subnivel․ De exemplu‚ configurația electronică a atomului de carbon este $1s^22s^22p^2$․ Aceasta înseamnă că atomul de carbon are doi electroni în subnivelul $1s$‚ doi electroni în subnivelul $2s$ și doi electroni în subnivelul $2p$․
Structura atomică
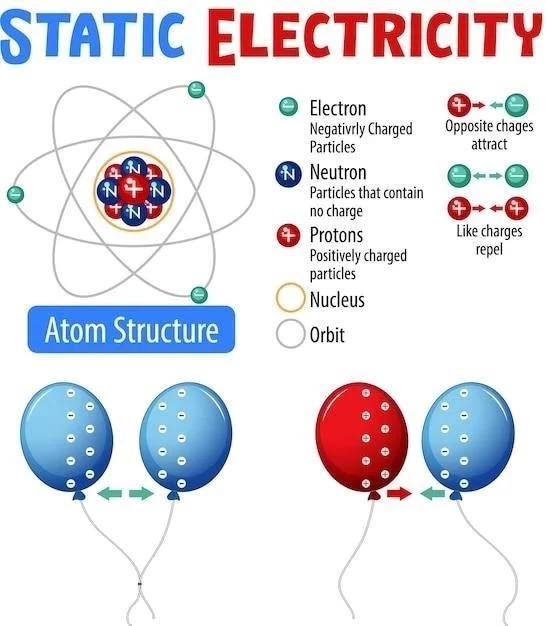
Atomul este unitatea fundamentală a materiei‚ constând dintr-un nucleu central‚ încărcat pozitiv‚ înconjurat de un nor de electroni‚ încărcați negativ․ Nucleul este format din protoni și neutroni‚ ambele având o masă aproximativ egală․ Protonii au o sarcină electrică pozitivă‚ în timp ce neutronii sunt neutri din punct de vedere electric․ Numărul de protoni din nucleu‚ numit număr atomic (Z)‚ definește identitatea elementului chimic․
Electronii‚ cu o masă mult mai mică decât protonii și neutronii‚ se rotesc în jurul nucleului în niveluri de energie definite․ Aceste niveluri de energie sunt cuantificate‚ adică electronii pot ocupa doar anumite energii discrete․ Modelul atomic al lui Bohr a fost primul model care a explicat cuantificarea nivelurilor de energie‚ presupunând că electronii se rotesc în jurul nucleului pe orbite circulare specifice․ Cu toate acestea‚ modelul lui Bohr a fost înlocuit ulterior de modelul cuantic‚ care oferă o imagine mai precisă a structurii atomice․
Modelul cuantic descrie electronii ca unde de probabilitate‚ cu o anumită probabilitate de a fi găsiți într-un anumit punct din spațiu․ Acest model este bazat pe patru numere cuantice⁚ numărul cuantic principal (n)‚ numărul cuantic azimutal (l)‚ numărul cuantic magnetic (ml) și numărul cuantic de spin (ms)․
Modelul atomic al lui Bohr
Modelul atomic al lui Bohr‚ propus în 1913‚ a fost o încercare de a explica structura atomului și comportamentul electronilor în jurul nucleului․ Modelul lui Bohr a fost o îmbunătățire semnificativă față de modelul atomic al lui Rutherford‚ care descria atomul ca un nucleu pozitiv înconjurat de electroni negativi‚ fără a specifica aranjamentul lor․
Modelul lui Bohr a postulat că electronii se mișcă pe orbite circulare bine definite în jurul nucleului‚ fiecare orbită având o energie specifică․ Electronii pot sări de la o orbită la alta‚ absorbând sau eliberând energie în formă de fotoni․ Această energie este cuantificată‚ adică electronii pot ocupa doar anumite energii discrete․
Modelul lui Bohr a explicat cu succes spectrul de emisie al atomului de hidrogen‚ dar nu a reușit să explice spectrul altor atomi mai complecși․ De asemenea‚ modelul lui Bohr nu a putut explica fenomenele de spin electronic și de interacțiune spin-orbită․
În ciuda limitărilor sale‚ modelul lui Bohr a fost un pas important în dezvoltarea înțelegerii structurii atomice și a deschis calea pentru dezvoltarea modelului cuantic․
Modelul cuantic
Modelul cuantic al atomului‚ dezvoltat în secolul XX‚ a revoluționat înțelegerea structurii atomice‚ oferind o descriere mai precisă a comportamentului electronilor în atom․ Modelul cuantic se bazează pe principiile mecanicii cuantice‚ care descriu natura duală a luminii‚ atât ca undă‚ cât și ca particulă․
În modelul cuantic‚ electronii nu mai sunt considerați particule care se mișcă pe orbite definite‚ ci mai degrabă ca unde de probabilitate‚ descrise de funcții de undă․ Aceste funcții de undă‚ numite și orbitali atomici‚ determină probabilitatea de a găsi un electron într-un anumit punct din spațiu․
Modelul cuantic introduce conceptul de numere cuantice‚ care descriu proprietățile electronilor‚ cum ar fi energia‚ momentul unghiular și spinul․ Numerele cuantice permit o descriere mai precisă a configurației electronice a atomilor și a proprietăților lor chimice․
Modelul cuantic a fost o descoperire majoră în chimie‚ permițând o înțelegere mai profundă a legăturilor chimice‚ a reacțiilor chimice și a proprietăților materialelor․
Configurația electronică
Configurația electronică a unui atom descrie modul în care electronii sunt aranjați în jurul nucleului‚ specificând numărul de electroni din fiecare nivel de energie și subnivel․ Această configurație este o reprezentare schematică a modului în care electronii sunt distribuiți în orbitalii atomici‚ conform principiilor mecanicii cuantice․
Configurația electronică este esențială pentru înțelegerea proprietăților chimice ale elementelor‚ deoarece determină modul în care atomii interacționează cu alți atomi pentru a forma legături chimice․ Electronii din ultimul nivel de energie‚ numiți electroni de valență‚ sunt cei mai implicați în formarea legăturilor chimice․
Configurația electronică este reprezentată printr-o notație specifică‚ care indică numărul de electroni din fiecare subnivel․ De exemplu‚ configurația electronică a atomului de carbon este 1s22s22p2‚ indicând faptul că are doi electroni în subnivelul 1s‚ doi electroni în subnivelul 2s și doi electroni în subnivelul 2p․
Înțelegerea configurației electronice este esențială pentru studiul chimiei‚ permițând predicția proprietăților chimice ale elementelor‚ interpretarea reacțiilor chimice și înțelegerea legăturilor chimice․
Numerele cuantice
Numerele cuantice sunt un set de patru valori care descriu proprietățile cuantificate ale electronilor dintr-un atom․ Aceste numere oferă o descriere completă a stării cuantice a unui electron‚ incluzând energia‚ forma și orientarea spațială a orbitalului său․
Primul număr cuantic‚ numărul cuantic principal (n)‚ descrie nivelul de energie al electronului․ n poate fi orice număr întreg pozitiv‚ cum ar fi 1‚ 2‚ 3 etc․‚ cu valori mai mari indicând niveluri de energie mai înalte․
Al doilea număr cuantic‚ numărul cuantic al momentului unghiular sau numărul cuantic azimutal (l)‚ descrie forma orbitalului și are valori cuprinse între 0 și n-1․ l = 0 corespunde unui orbital s‚ l = 1 corespunde unui orbital p‚ l = 2 corespunde unui orbital d și l = 3 corespunde unui orbital f․
Al treilea număr cuantic‚ numărul cuantic magnetic (ml)‚ descrie orientarea spațială a orbitalului în spațiu și are valori cuprinse între -l și +l‚ inclusiv 0․
Ultimul număr cuantic‚ numărul cuantic de spin (ms)‚ descrie momentul unghiular intrinsec al electronului‚ care este asociat cu rotația sa․ ms poate fi fie +1/2‚ fie -1/2․
Diagrama orbitală
Diagrama orbitală este o reprezentare grafică a configurației electronice a unui atom‚ care arată distribuția electronilor în orbitalii atomici․ Fiecare orbital este reprezentat printr-un pătrat sau un cerc‚ iar electronii sunt reprezentați prin săgeți․
Diagrama orbitală respectă principiul lui Hund‚ care prevede că electronii ocupă orbitalii individuali cu spinuri paralele înainte de a se împerechea în același orbital․ În plus‚ diagrama orbitală respectă principiul excluderii lui Pauli‚ care prevede că nu există doi electroni dintr-un atom care să aibă aceleași valori pentru toate cele patru numere cuantice․
De exemplu‚ diagrama orbitală a atomului de carbon (C) are configurația electronică 1s22s22p2․ Diagrama orbitală arată doi electroni în orbitalul 1s‚ doi electroni în orbitalul 2s și doi electroni în orbitalii 2p‚ cu unul în fiecare orbital 2p înainte de a se împerechea în același orbital․
Diagrama orbitală este un instrument util pentru vizualizarea configurației electronice a unui atom și pentru înțelegerea comportamentului chimic al elementelor․
Regulile de umplere a orbitalilor
Umplerea orbitalilor atomici cu electroni urmează anumite reguli fundamentale‚ stabilite prin principiile mecanicii cuantice․ Aceste reguli asigură o ordine specifică de umplere a orbitalilor și permit predicția configurației electronice a atomilor․
Prima regulă este principiul lui Aufbau‚ care prevede că electronii ocupă orbitalii cu energie crescătoare․ Orbitalii cu energie mai mică sunt umpluți înainte de orbitalii cu energie mai mare․
A doua regulă este principiul excluderii lui Pauli‚ care prevede că nu există doi electroni dintr-un atom care să aibă aceleași valori pentru toate cele patru numere cuantice․ Aceasta înseamnă că fiecare orbital poate conține maximum doi electroni‚ cu spinuri opuse․
A treia regulă este regula lui Hund‚ care prevede că electronii ocupă orbitalii individuali cu spinuri paralele înainte de a se împerechea în același orbital․ Aceasta asigură o distribuție mai stabilă a electronilor în orbitali․
Aceste reguli sunt esențiale pentru înțelegerea configurației electronice și a proprietăților chimice ale elementelor․
Periodicitatea proprietăților atomice
Aranjarea elementelor în tabelul periodic reflectă o periodicitate remarcabilă a proprietăților lor chimice․ Această periodicitate este o consecință directă a configurației electronice a atomilor․ Proprietățile atomice‚ cum ar fi energia de ionizare‚ electronegativitatea și raza atomică‚ variază în mod regulat de-a lungul perioadelor și grupelor din tabelul periodic․
Energia de ionizare este energia necesară pentru a îndepărta un electron dintr-un atom gazos․ Această proprietate crește de-a lungul unei perioade‚ deoarece atracția nucleului asupra electronilor de valență crește‚ iar electronii sunt mai strâns legați․ Energia de ionizare scade în josul unui grup‚ deoarece electronii de valență sunt mai îndepărtați de nucleu și sunt mai ușor de îndepărtat․
Electronegativitatea este o măsură a atracției unui atom pentru electronii din legătura chimică․ Electronegativitatea crește de-a lungul unei perioade‚ deoarece atracția nucleului asupra electronilor crește․ Electronegativitatea scade în josul unui grup‚ deoarece electronii de valență sunt mai îndepărtați de nucleu și sunt mai puțin atrași de acesta․
Raza atomică este o măsură a dimensiunii unui atom․ Raza atomică scade de-a lungul unei perioade‚ deoarece sarcina nucleară crește și electronii sunt atrași mai strâns de nucleu․ Raza atomică crește în josul unui grup‚ deoarece numărul de nivele de energie crește și electronii de valență sunt mai îndepărtați de nucleu․
Energia de ionizare
Energia de ionizare este o măsură a energiei necesare pentru a îndepărta un electron dintr-un atom gazos‚ formând un ion pozitiv․ Această proprietate este o măsură a cât de strâns este legat un electron de atom․ Energia de ionizare este exprimată în unități de jouli pe mol (J/mol) sau electronvolți (eV)․
Primul potențial de ionizare se referă la energia necesară pentru a îndepărta primul electron dintr-un atom neutru․ Al doilea potențial de ionizare se referă la energia necesară pentru a îndepărta al doilea electron dintr-un ion cu o singură sarcină pozitivă‚ și așa mai departe․
Energia de ionizare variază în mod regulat în tabelul periodic․ De-a lungul unei perioade‚ energia de ionizare crește‚ deoarece atracția nucleului asupra electronilor de valență crește‚ iar electronii sunt mai strâns legați․ În josul unui grup‚ energia de ionizare scade‚ deoarece electronii de valență sunt mai îndepărtați de nucleu și sunt mai ușor de îndepărtat․
Energia de ionizare este o proprietate importantă care influențează reactivitatea chimică a elementelor․ Elementele cu energii de ionizare scăzute tind să fie mai reactive‚ deoarece pierd mai ușor electroni și formează cationi․
Electronegativitatea
Electronegativitatea este o măsură a tendinței unui atom dintr-o moleculă de a atrage electronii din legătura covalentă․ Este o proprietate chimică care reflectă capacitatea unui atom de a atrage electroni într-o legătură․ Electronegativitatea este o proprietate relativă‚ adică nu poate fi măsurată direct‚ dar poate fi comparată între atomi diferiți․
Scara Pauling este cea mai comună scară de electronegativitate․ Pe această scară‚ electronegativitatea este exprimată ca un număr fără unități‚ cu valori cuprinse între 0 și 4․ Elementele cu electronegativitate ridicată‚ cum ar fi oxigenul și clorul‚ atrag puternic electronii din legăturile covalente‚ în timp ce elementele cu electronegativitate scăzută‚ cum ar fi litiul și sodiul‚ atrag mai slab electronii․
Electronegativitatea variază în mod regulat în tabelul periodic․ De-a lungul unei perioade‚ electronegativitatea crește‚ deoarece atracția nucleului asupra electronilor de valență crește․ În josul unui grup‚ electronegativitatea scade‚ deoarece electronii de valență sunt mai îndepărtați de nucleu și sunt mai ușor de îndepărtat․
Electronegativitatea este o proprietate importantă care influențează natura legăturilor chimice dintre atomi․ Diferența de electronegativitate dintre doi atomi dintr-o legătură covalentă determină polaritatea legăturii․
Raza atomică
Raza atomică este o măsură a dimensiunii unui atom․ Este definită ca distanța medie dintre nucleul unui atom și electronul său cel mai exterior․ Raza atomică este o proprietate periodică‚ adică variază în mod regulat în tabelul periodic․
În general‚ raza atomică crește în josul unui grup din tabelul periodic‚ deoarece numărul de nivele de energie (n) crește‚ iar electronii de valență sunt mai îndepărtați de nucleu․ De-a lungul unei perioade‚ raza atomică scade‚ deoarece numărul de protoni din nucleu crește‚ iar atracția nucleului asupra electronilor de valență este mai puternică․
Raza atomică este un factor important care influențează proprietățile chimice ale elementelor․ Atomii mai mari au tendința de a forma legături mai slabe‚ deoarece electronii de valență sunt mai puțin atrași de nucleu․ De asemenea‚ atomii mai mari au tendința de a fi mai reactivi‚ deoarece electronii de valență sunt mai ușor de îndepărtat․
Raza atomică este o proprietate importantă pentru a înțelege comportamentul elementelor în reacțiile chimice și în formarea compușilor․
Relația dintre configurația electronică și proprietățile chimice
Configurația electronică a unui atom determină în mod direct proprietățile sale chimice․ Această relație se bazează pe conceptul de electroni de valență‚ care sunt electronii din ultimul strat de energie al unui atom․ Electronii de valență sunt cei care participă la formarea legăturilor chimice․
Numărul și aranjarea electronilor de valență influențează direct tipul și numărul de legături chimice pe care un atom le poate forma․ De exemplu‚ atomii cu un singur electron de valență au tendința de a forma o singură legătură‚ în timp ce atomii cu doi sau mai mulți electroni de valență pot forma mai multe legături․
Configurația electronică poate prezice‚ de asemenea‚ reactivitatea unui element․ Atomii cu un singur electron de valență‚ cum ar fi $Li$ sau $Na$‚ sunt foarte reactivi‚ deoarece au tendința de a pierde acest electron pentru a obține o configurație electronică stabilă․ Atomii cu opt electroni de valență‚ cum ar fi $Ne$ sau $Ar$‚ sunt foarte stabili și nereactivi․
Înțelegerea relației dintre configurația electronică și proprietățile chimice este esențială pentru prezicerea comportamentului elementelor în reacțiile chimice․
Electronii de valență
Electronii de valență sunt electronii din ultimul strat de energie al unui atom․ Aceștia sunt cei care participă la formarea legăturilor chimice‚ deoarece sunt cei mai puțin legați de nucleu și‚ prin urmare‚ cei mai disponibili pentru a interacționa cu alți atomi․ Numărul de electroni de valență ai unui atom determină tipul și numărul de legături pe care le poate forma․
De exemplu‚ un atom de carbon are patru electroni de valență‚ ceea ce îi permite să formeze patru legături covalente cu alți atomi․ Un atom de oxigen are șase electroni de valență‚ dar poate forma doar două legături covalente‚ deoarece are nevoie de doi electroni suplimentari pentru a obține o configurație electronică stabilă․
Electronii de valență joacă un rol crucial în determinarea proprietăților chimice ale unui element․ Ei influențează reactivitatea‚ tipul de legături formate și chiar forma moleculelor․
Legături chimice
Legăturile chimice sunt forțele de atracție care țin atomii împreună în molecule și compuși․ Aceste forțe apar ca rezultat al interacțiunii dintre electronii de valență ai atomilor․ Există mai multe tipuri de legături chimice‚ dar cele mai comune sunt legăturile covalente și ionice․
Legăturile covalente se formează atunci când doi atomi împart electroni de valență․ Această împărțire conduce la o configurație electronică stabilă pentru ambii atomi․ De exemplu‚ o moleculă de apă (H2O) este formată din două atomi de hidrogen și un atom de oxigen‚ legați prin legături covalente․
Legăturile ionice se formează atunci când un atom cedează un electron de valență altui atom․ Atomul care pierde electronul devine un ion pozitiv (cation)‚ iar atomul care câștigă electronul devine un ion negativ (anion)․ Atracția electrostatică dintre cation și anion este ceea ce formează legătura ionică․ De exemplu‚ sarea de masă (NaCl) este formată din ioni de sodiu (Na+) și ioni de clor (Cl–)․
Spectroscopie
Spectroscopia este o tehnică utilizată pentru a studia interacțiunea dintre radiația electromagnetică și materie․ Prin analiza spectrului de radiație emis sau absorbit de o substanță‚ se pot obține informații despre structura atomilor și moleculelor‚ precum și despre compoziția și proprietățile substanței․
În contextul configurațiilor electronice‚ spectroscopia este o unealtă valoroasă pentru a confirma și a aprofunda înțelegerea nivelurilor de energie ale electronilor․ Când un atom absoarbe energie‚ electronii săi pot sări la niveluri de energie mai înalte․ Când acești electroni revin la nivelul lor de energie inițial‚ ei emit fotoni de lumină cu o energie specifică․ Această lumină poate fi detectată și analizată pentru a determina configurația electronică a atomului․
Spectroscopia poate fi împărțită în mai multe tipuri‚ inclusiv spectroscopia atomică‚ care se concentrează pe atomi individuali‚ și spectroscopia moleculară‚ care se concentrează pe molecule․ Spectroscopia atomică este utilizată pentru a studia configurația electronică a atomilor individuali‚ în timp ce spectroscopia moleculară este utilizată pentru a studia interacțiunile dintre atomi în molecule․
Articolul este foarte util pentru cei care doresc să înțeleagă principiile de bază ale configurațiilor electronice. Explicația este clară și concisă, iar exemplele utilizate sunt relevante și ușor de înțeles. Ar fi benefic să se includă o secțiune despre diagramele atomice și despre reprezentarea grafică a configurațiilor electronice.
Articolul este foarte util pentru cei care doresc să înțeleagă principiile de bază ale configurațiilor electronice. Explicația este clară și concisă, iar exemplele utilizate sunt relevante și ușor de înțeles. Ar fi benefic să se includă o secțiune despre relația dintre configurațiile electronice și proprietățile chimice ale elementelor.
Apreciez abordarea didactică a articolului, care facilitează înțelegerea configurațiilor electronice chiar și pentru cei care nu au o pregătire avansată în chimie. Utilizarea diagramelor atomice și a notațiilor cuantice este clară și eficientă. Ar fi utilă adăugarea unor exemple practice de aplicare a configurațiilor electronice în predicția reactivității chimice și în explicarea proprietăților elementelor.
Articolul oferă o introducere excelentă în configurațiile electronice, acoperind aspecte importante precum structura atomică, numerele cuantice și subnivelurile electronice. Explicația este clară și concisă, iar exemplele utilizate sunt relevante și ușor de înțeles. Ar fi benefic să se includă o secțiune despre relația dintre configurațiile electronice și proprietățile chimice ale elementelor.
Articolul este bine scris și prezintă o introducere excelentă în configurațiile electronice. Explicația numerelor cuantice și a subnivelurilor electronice este detaliată și ușor de înțeles. Ar fi util să se adauge o discuție despre relația dintre configurațiile electronice și proprietățile chimice ale elementelor, precum și despre aplicațiile practice ale configurațiilor electronice în chimie.
Articolul este bine scris și prezintă o introducere excelentă în configurațiile electronice. Explicația numerelor cuantice și a subnivelurilor electronice este detaliată și ușor de înțeles. Ar fi util să se adauge o discuție despre aplicațiile practice ale configurațiilor electronice în chimie, precum și despre excepțiile de la regula lui Hund.
Articolul oferă o prezentare cuprinzătoare a configurațiilor electronice, acoperind aspecte importante precum structura atomică, numerele cuantice și subnivelurile electronice. Explicația este clară și concisă, iar exemplele utilizate sunt relevante și ușor de înțeles. Ar fi benefic să se includă o secțiune despre diagramele atomice și despre reprezentarea grafică a configurațiilor electronice.
Articolul prezintă o introducere clară și concisă în conceptul de configurații electronice, evidențiind importanța lor în înțelegerea proprietăților chimice ale elementelor. Explicația structurii atomice este bine structurată și ușor de înțeles, incluzând o descriere detaliată a numerelor cuantice și a subnivelurilor electronice. Exemplele utilizate pentru a ilustra configurațiile electronice sunt relevante și ajută la consolidarea înțelegerii conceptului.
Articolul oferă o prezentare cuprinzătoare a configurațiilor electronice, acoperind aspecte importante precum structura atomică, numerele cuantice și subnivelurile electronice. Explicația este clară și concisă, iar exemplele utilizate sunt relevante și ușor de înțeles. Ar fi benefic să se includă o secțiune despre excepțiile de la regula lui Hund și despre configurațiile electronice ale ionilor.