Efectul Ionului Comun

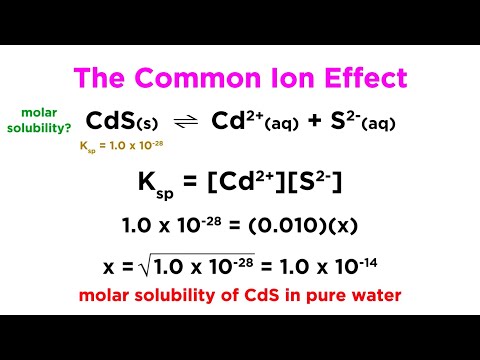
Efectul Ionului Comun
Efectul ionului comun este un fenomen chimic care descrie scăderea solubilității unui compus ionic slab solubil atunci când se adaugă la soluție un ion comun cu compusul respectiv.
Introducere
Efectul ionului comun este un principiu fundamental în chimia soluțiilor, care explică comportamentul solubilității compușilor ionici în prezența unor ioni comuni. Acest efect se bazează pe principiul lui Le Chatelier, care afirmă că un sistem în echilibru va răspunde la o modificare a condițiilor prin deplasarea echilibrului în direcția care reduce stresul aplicat. În cazul solubilității, stresul este adăugarea unui ion comun, iar sistemul răspunde prin scăderea solubilității compusului ionic.
Solubilitatea unui compus ionic este o măsură a cantității de compus ionic care se poate dizolva într-o anumită cantitate de solvent la o temperatură dată. Solubilitatea este o proprietate specifică fiecărui compus ionic, iar factorii care o influențează includ natura compusului, temperatura și prezența altor specii chimice în soluție.
Efectul ionului comun este un fenomen important care influențează o gamă largă de procese chimice și biologice. De exemplu, efectul ionului comun este folosit pentru a controla solubilitatea compușilor ionici în diverse aplicații industriale, cum ar fi purificarea apei, tratarea apelor uzate și sinteza materialelor. De asemenea, acest efect joacă un rol important în procesele biologice, cum ar fi absorbția nutrienților de către plante și reglarea pH-ului în sistemele biologice.
Înțelegerea efectului ionului comun este esențială pentru a prezice și controla comportamentul solubilității compușilor ionici în diverse sisteme chimice și biologice. Prin aplicarea principiului lui Le Chatelier, putem explica modul în care adăugarea unui ion comun afectează solubilitatea compusului ionic și putem prezice comportamentul sistemului în diverse condiții.
Solubilitatea și Echilibrul
Solubilitatea unui compus ionic este o măsură a cantității de compus ionic care se poate dizolva într-o anumită cantitate de solvent la o temperatură dată. Solubilitatea este o proprietate specifică fiecărui compus ionic, iar factorii care o influențează includ natura compusului, temperatura și prezența altor specii chimice în soluție;
Echilibrul de solubilitate este un echilibru dinamic între un compus ionic solid și ionii săi în soluție. De exemplu, considerăm un compus ionic generic, MX, care se dizolvă în apă pentru a forma ionii M+ și X–⁚
$$MX(s) ightleftharpoons M^+(aq) + X^-(aq)$$
Echilibrul de solubilitate este descris de produsul de solubilitate, Ksp, care este o constantă de echilibru care exprimă solubilitatea unui compus ionic într-un solvent dat. Produsul de solubilitate este dat de produsul concentrațiilor ionilor în soluție saturată, fiecare ridicat la puterea coeficientului stoichiometric din ecuația de echilibru⁚
$$K_{sp} = [M^+][X^-].$$
Produsul de solubilitate este o constantă pentru un compus ionic dat la o temperatură dată. Valoarea lui Ksp indică solubilitatea compusului ionic⁚ cu cât Ksp este mai mare, cu atât compusul ionic este mai solubil.
Compuși Ionici și Soluții
Compușii ionici sunt substanțe formate din ioni pozitivi (cationi) și ioni negativi (anioni) legați prin forțe electrostatice. Acești compuși sunt de obicei solizi la temperatura camerei, având o structură cristalină ordonată. Atunci când un compus ionic este adăugat într-un solvent polar, cum ar fi apa, ionii din rețeaua cristalină sunt atrași de moleculele de solvent, ceea ce duce la dizolvarea compusului.
Soluția rezultată este o soluție ionică, care conține ioni liberi capabili să conducă curentul electric. Solubilitatea unui compus ionic este o măsură a cantității de compus ionic care se poate dizolva într-o anumită cantitate de solvent la o temperatură dată. Solubilitatea este o proprietate specifică fiecărui compus ionic, iar factorii care o influențează includ natura compusului, temperatura și prezența altor specii chimice în soluție.
Echilibrul de solubilitate este un echilibru dinamic între un compus ionic solid și ionii săi în soluție. De exemplu, considerăm un compus ionic generic, MX, care se dizolvă în apă pentru a forma ionii M+ și X–⁚
$$MX(s) ightleftharpoons M^+(aq) + X^-(aq)$$
Echilibrul de solubilitate este descris de produsul de solubilitate, Ksp, care este o constantă de echilibru care exprimă solubilitatea unui compus ionic într-un solvent dat.
Definirea Solubilității
Solubilitatea unui compus ionic este o măsură a capacității sale de a se dizolva într-un solvent dat. Această capacitate este exprimată de obicei ca concentrația ionilor dizolvați în soluție saturată, adică soluția în care nu mai poate fi dizolvat compus ionic. Solubilitatea poate fi exprimată în diferite unități, cum ar fi grame per 100 ml de solvent (g/100 ml), moli per litru (mol/L) sau moli per kilogram de solvent (mol/kg).
Solubilitatea unui compus ionic depinde de mai mulți factori, inclusiv temperatura, presiunea, natura solventului și prezența altor substanțe în soluție. În general, solubilitatea crește cu temperatura, deoarece energia termică ajută la ruperea legăturilor dintre ionii din rețeaua cristalină. Prezența altor substanțe în soluție poate afecta solubilitatea prin interacțiuni intermoleculare, cum ar fi formarea de complexe sau formarea de precipitate.
Pentru a defini solubilitatea, se utilizează conceptul de molaritate a solubilității (s). Molaritatea solubilității este concentrația ionilor metalici dintr-o soluție saturată, exprimată în mol/L. De exemplu, dacă un compus ionic MX se dizolvă în apă, iar solubilitatea sa este s mol/L, atunci concentrația ionilor M+ și X– în soluție saturată va fi egală cu s mol/L:
$$[M^+]=[X^-]=s$$
Echilibrul de Solubilitate
Dizolvarea unui compus ionic slab solubil în apă este un proces reversibil, care poate fi reprezentat printr-un echilibru de solubilitate. Echilibrul de solubilitate este o stare de echilibru dinamic în care viteza de dizolvare a compusului ionic este egală cu viteza de precipitare a ionilor din soluție.
De exemplu, pentru un compus ionic MX slab solubil, echilibrul de solubilitate poate fi scris astfel⁚
$$MX(s) ightleftharpoons M^+(aq) + X^-(aq)$$
Constanta de echilibru pentru această reacție este cunoscută ca produsul de solubilitate (Ksp) și este definită ca produsul concentrațiilor ionilor metalici și nemetalici din soluție saturată, fiecare ridicat la puterea coeficientului stoechiometric din ecuația echilibrului de solubilitate.
Pentru compusul MX, produsul de solubilitate este⁚
$$K_{sp} = [M^+][X^-]=s^2$$
Produsul de solubilitate este o constantă de echilibru specifică pentru fiecare compus ionic și este o măsură a solubilității compusului ionic la o temperatură dată. Cu cât produsul de solubilitate este mai mic, cu atât solubilitatea compusului ionic este mai mică.
Descrierea Efectului
Efectul ionului comun este un fenomen care descrie scăderea solubilității unui compus ionic slab solubil atunci când se adaugă la soluție un ion comun cu compusul respectiv. Această scădere a solubilității este o consecință directă a principiului lui Le Chatelier, care afirmă că un sistem în echilibru va răspunde la o modificare a condițiilor prin deplasarea echilibrului în direcția care va contracara modificarea.
În cazul efectului ionului comun, adăugarea unui ion comun la soluția saturată a unui compus ionic slab solubil reprezintă o modificare a condițiilor de echilibru. Pentru a contracara această modificare, echilibrul de solubilitate se va deplasa spre stânga, favorizând precipitarea compusului ionic din soluție.
Acest lucru are ca rezultat o scădere a concentrației ionilor metalici și nemetalici din soluție, ceea ce duce la o scădere a solubilității compusului ionic.
De exemplu, dacă adăugăm un ion comun, cum ar fi ionul clorură (Cl–), la o soluție saturată de clorură de argint (AgCl), echilibrul de solubilitate se va deplasa spre stânga, favorizând precipitarea AgCl din soluție.
Aceasta va duce la o scădere a concentrației ionilor de argint (Ag+) din soluție, ceea ce se traduce printr-o scădere a solubilității AgCl.
Aplicarea Principiului lui Le Chatelier
Principiul lui Le Chatelier explică în mod clar efectul ionului comun. Principiul afirmă că un sistem în echilibru va răspunde la o modificare a condițiilor prin deplasarea echilibrului în direcția care va contracara modificarea. În cazul efectului ionului comun, adăugarea unui ion comun la soluția saturată a unui compus ionic slab solubil reprezintă o modificare a condițiilor de echilibru.
Pentru a contracara această modificare, echilibrul de solubilitate se va deplasa spre stânga, favorizând precipitarea compusului ionic din soluție. Aceasta se traduce printr-o scădere a concentrației ionilor metalici și nemetalici din soluție, ceea ce duce la o scădere a solubilității compusului ionic.
De exemplu, considerând echilibrul de solubilitate al clorurii de argint (AgCl)⁚
$AgCl(s) ightleftharpoons Ag^+(aq) + Cl^-(aq)$
Adăugarea unui ion comun, cum ar fi ionul clorură (Cl–), va deplasa echilibrul spre stânga, favorizând precipitarea AgCl din soluție. Aceasta va duce la o scădere a concentrației ionilor de argint (Ag+) din soluție, ceea ce se traduce printr-o scădere a solubilității AgCl.
Influența Efectului Ionului Comun
Efectul ionului comun are o influență semnificativă asupra solubilității compușilor ionici slab solubili. Această influență se manifestă în două aspecte principale⁚
- Scăderea solubilității⁚ Efectul ionului comun reduce solubilitatea compusului ionic slab solubil, deoarece echilibrul de solubilitate se deplasează spre stânga, favorizând precipitarea compusului din soluție. Aceasta se traduce printr-o scădere a concentrației ionilor metalici și nemetalici din soluție, ceea ce duce la o scădere a solubilității compusului ionic.
- Precipitații⁚ În anumite cazuri, adăugarea unui ion comun poate duce la precipitarea compusului ionic slab solubil din soluție. Aceasta se întâmplă atunci când concentrația ionului comun adăugat este suficient de mare pentru a depăși produsul de solubilitate al compusului ionic, determinând formarea unui precipitat solid.
Efectul ionului comun este un concept important în chimie, având aplicații practice în diverse domenii, cum ar fi analiza chimică, sinteza compușilor și tratarea apei.
Molaritatea Solubilității
Molaritatea solubilității, notată cu $s$, reprezintă concentrația molară a ionului metalic dintr-o soluție saturată a unui compus ionic slab solubil. Această valoare este o măsură a solubilității compusului ionic în condiții date.
Efectul ionului comun are o influență directă asupra molarității solubilității. Adăugarea unui ion comun la o soluție saturată a unui compus ionic slab solubil va reduce molaritatea solubilității. Aceasta se datorează deplasării echilibrului de solubilitate spre stânga, favorizând precipitarea compusului ionic din soluție.
De exemplu, dacă adăugăm un ion comun la o soluție saturată de AgCl, echilibrul de solubilitate se va deplasa spre stânga, reducând concentrația ionilor Ag+ și Cl- din soluție. Aceasta se traduce printr-o scădere a molarității solubilității AgCl.
Molaritatea solubilității este un concept important în chimia analitică, deoarece poate fi utilizat pentru a determina solubilitatea compușilor ionici și pentru a prezice efectul ionului comun asupra solubilității.
Precipitații
Precipitația este un proces chimic prin care un compus ionic insolubil se separă din soluție sub formă de solid. Acest proces este influențat direct de efectul ionului comun. Adăugarea unui ion comun la o soluție saturată a unui compus ionic slab solubil poate determina precipitarea compusului ionic din soluție.
Efectul ionului comun favorizează precipitarea prin deplasarea echilibrului de solubilitate spre stânga, reducând concentrația ionilor din soluție. Această deplasare a echilibrului determină formarea mai multor precipitații, deoarece concentrația ionilor din soluție scade sub valoarea produsului de solubilitate.
De exemplu, dacă adăugăm un ion comun la o soluție saturată de AgCl, echilibrul de solubilitate se va deplasa spre stânga, reducând concentrația ionilor Ag+ și Cl- din soluție. Această scădere a concentrației ionilor va determina precipitarea AgCl din soluție, deoarece concentrația ionilor Ag+ și Cl- din soluție scade sub valoarea produsului de solubilitate.
Precipitația este un proces important în chimia analitică, deoarece poate fi utilizat pentru a separa și identifica compușii ionici. Efectul ionului comun poate fi utilizat pentru a controla precipitarea și a obține o separare mai eficientă a compușilor ionici.
Exemple de Aplicații
Efectul ionului comun are numeroase aplicații practice în diverse domenii, de la chimia analitică la biochimie și geologie. Acesta este un principiu fundamental care explică comportamentul soluțiilor ionice și influențează o serie de procese chimice și biochimice.
În chimia analitică, efectul ionului comun este utilizat pentru a controla precipitarea și a obține o separare mai eficientă a compușilor ionici. De exemplu, în analiza gravimetrică, se adaugă un ion comun la o soluție saturată a unui compus ionic slab solubil pentru a precipita compusul ionic din soluție și a-l separa de alți compuși. Această tehnică permite determinarea cantitativă a compusului ionic.
În biochimie, efectul ionului comun joacă un rol important în reglarea solubilității proteinelor și a altor molecule biologice. Concentrația ionilor în fluidele biologice poate influența solubilitatea și activitatea acestor molecule, având un impact semnificativ asupra funcțiilor biologice.
În geologie, efectul ionului comun este implicat în formarea mineralelor și în procesele de dizolvare și precipitare din sol și apă. Concentrația ionilor din sol și apă poate influența solubilitatea mineralelor, afectând compoziția și structura rocilor și a solului.
Exemple din Chimie
Efectul ionului comun are numeroase aplicații practice în diverse domenii ale chimiei, de la analiza chimică la sinteza chimică și chimia mediului; Acesta este un principiu fundamental care explică comportamentul soluțiilor ionice și influențează o serie de reacții chimice.
Un exemplu clasic este precipitarea clorurii de argint (AgCl), un compus ionic slab solubil. Când se adaugă ioni de clorură (Cl-) la o soluție saturată de AgCl, solubilitatea clorurii de argint scade, deoarece echilibrul de solubilitate este deplasat spre formarea mai multor precipitații de AgCl. Aceasta se datorează faptului că adăugarea de ioni de clorură crește concentrația ionilor Cl- în soluție, ceea ce determină o scădere a concentrației ionilor Ag+ din soluție, conform principiului lui Le Chatelier.
Un alt exemplu este utilizarea efectului ionului comun pentru a controla solubilitatea compușilor metalici. De exemplu, în procesul de galvanizare, se adaugă ioni metalici la o soluție de sare metalică pentru a crește viteza de depunere a metalului pe un substrat. Efectul ionului comun poate fi utilizat pentru a optimiza procesul de galvanizare, controlând solubilitatea metalului în soluție.
În chimia mediului, efectul ionului comun joacă un rol important în procesele de precipitare și dizolvare a mineralelor din sol și apă. Concentrația ionilor din sol și apă poate influența solubilitatea mineralelor, afectând compoziția și structura rocilor și a solului.
Exemple din Biologie
Efectul ionului comun are o importanță semnificativă în diverse procese biologice, influențând de la absorbția nutrienților de către plante până la funcționarea organelor și sistemelor din corpul uman. Prin influențarea solubilității compușilor ionici, efectul ionului comun joacă un rol crucial în menținerea echilibrului ionic și a homeostaziei în organismele vii.
Un exemplu relevant este absorbția calciului (Ca2+) de către plante. Calciul este un nutrient esențial pentru creșterea și dezvoltarea plantelor, iar absorbția sa este influențată de concentrația ionilor de calciu în sol. Prezența altor cationi, cum ar fi magneziul (Mg2+), pot reduce solubilitatea compușilor de calciu în sol, afectând absorbția calciului de către plante. Acest fenomen poate duce la deficiențe de calciu în plante, manifestate prin diverse simptome, cum ar fi îngălbenirea frunzelor sau apariția unor anomalii în creștere.
În corpul uman, efectul ionului comun este implicat în reglarea echilibrului electrolitic, un aspect crucial pentru funcționarea normală a organelor și sistemelor. De exemplu, în rinichi, efectul ionului comun influențează reabsorbția ionilor de sodiu (Na+) și clorură (Cl-) din urină, contribuind la menținerea echilibrului hidroelectrolitic. De asemenea, efectul ionului comun joacă un rol important în funcționarea sistemului osos, influențând solubilitatea calciului în oase și contribuind la menținerea densității osoase.
În concluzie, efectul ionului comun este un principiu chimic fundamental care are aplicații semnificative în diverse domenii, inclusiv biologie, chimie și geologie. Înțelegerea acestui fenomen este esențială pentru a explica și controla o serie de procese naturale și tehnologice, de la absorbția nutrienților de către plante până la funcționarea organelor și sistemelor din corpul uman.
Concluzie
Efectul ionului comun, un fenomen chimic fundamental, demonstrează influența adăugării unui ion comun asupra solubilității unui compus ionic slab solubil. Acest principiu, bazat pe principiul lui Le Chatelier, explică scăderea solubilității compusului respectiv în prezența ionului comun. Aplicabilitatea sa se extinde dincolo de sfera chimică, influențând diverse procese din biologie, geologie și inginerie.
Înțelegerea efectului ionului comun este crucială pentru o serie de aplicații practice. De exemplu, în chimie analitică, acest principiu este utilizat pentru a controla solubilitatea precipitatelor, optimizând eficiența separării și determinării substanțelor. În biologie, efectul ionului comun joacă un rol esențial în reglarea echilibrului ionic și a homeostaziei în organismele vii, influențând absorbția nutrienților, funcționarea organelor și menținerea sănătății.
Efectul ionului comun evidențiază complexitatea interacțiunilor ionice în soluții și subliniază importanța echilibrului chimic în diverse procese naturale și tehnologice. Cunoașterea acestui principiu contribuie la o mai bună înțelegere a fenomenelor chimice și la o mai eficientă aplicare a principiilor chimice în diverse domenii.
Articolul prezintă o introducere clară și concisă a efectului ionului comun, evidențiând importanța sa în chimia soluțiilor. Explicația bazată pe principiul lui Le Chatelier este bine argumentată și ușor de înțeles. Apreciez de asemenea menționarea aplicațiilor practice ale efectului ionului comun, care demonstrează relevanța sa în diverse domenii.
Articolul este bine structurat și ușor de citit. Explicația efectului ionului comun este clară și concisă, iar exemplele folosite sunt relevante și ajută la o mai bună înțelegere a conceptului. Apreciez de asemenea prezența secțiunii dedicate solubilității și echilibrului, care aprofundează subiectul.
Articolul prezintă o introducere clară și concisă a efectului ionului comun, evidențiind importanța sa în chimia soluțiilor. Explicația bazată pe principiul lui Le Chatelier este bine argumentată și ușor de înțeles. Apreciez de asemenea menționarea aplicațiilor practice ale efectului ionului comun, care demonstrează relevanța sa în diverse domenii.
Articolul este bine scris și ușor de citit. Explicația efectului ionului comun este clară și concisă, iar exemplele folosite sunt relevante și ajută la o mai bună înțelegere a conceptului. Apreciez de asemenea prezența secțiunii dedicate solubilității și echilibrului, care aprofundează subiectul.
Articolul prezintă o introducere convingătoare, care captează atenția cititorului. Explicația efectului ionului comun este bine fundamentată, iar exemplele folosite sunt relevante și ajută la o mai bună înțelegere a conceptului. Apreciez de asemenea menționarea aplicațiilor practice ale efectului ionului comun, care demonstrează relevanța sa în diverse domenii.