Electrochimia

2.Celula electrochimică
O celulă galvanică‚ cunoscută și ca celulă voltaică‚ este un dispozitiv care convertește energia chimică în energie electrică printr-o reacție de oxidare-reducere.
2.Anodi și catodi
2.Electrolitul
2.4. Reacții de oxidare-reducere
2.5. Forța electromotoare (FEM) și diferența de potențial
2.6. Legea lui Faraday
2.7. Ecuația lui Nernst
Celule galvanice (voltaic)
1.Definiție
1.Istoria celulelor galvanice
1.2.Stiva voltaică
1.2.Celula Daniell
1.2.Celula Leclanché
1.Aplicații ale celulelor galvanice
2.Definiție
2.Tipuri de baterii
2.Caracteristicile bateriilor
2.4. Aplicații ale bateriilor
3.Definiție
3.Principiul de funcționare
3.Tipuri de celule de combustie
3.4. Aplicații ale celulelor de combustie
2.Electroliză
2.Electrochimia în procesele industriale
Electrochimia este o ramură a chimiei care studiază relația dintre reacțiile chimice și energia electrică. Această disciplină se concentrează pe conversia energiei chimice în energie electrică și invers‚ explorând procesele care au loc la interfața dintre un conductor electronic (metal sau semiconductor) și un conductor ionic (electrolit).
2.Celula electrochimică
2.Anodi și catodi
2.Electrolitul
2.4. Reacții de oxidare-reducere
2.5. Forța electromotoare (FEM) și diferența de potențial
2.6. Legea lui Faraday
2.7. Ecuația lui Nernst
Celule galvanice (voltaic)
1.Definiție
1.Istoria celulelor galvanice
1.2.Stiva voltaică
1.2.Celula Daniell
1.2.Celula Leclanché
1.Aplicații ale celulelor galvanice
2.Definiție
2.Tipuri de baterii
2.Caracteristicile bateriilor
2.4. Aplicații ale bateriilor
3.Definiție
3.Principiul de funcționare
3.Tipuri de celule de combustie
3.4. Aplicații ale celulelor de combustie
2.Electroliză
2.Electrochimia în procesele industriale
Electrochimia este o ramură a chimiei care studiază relația dintre reacțiile chimice și energia electrică. Această disciplină se concentrează pe conversia energiei chimice în energie electrică și invers‚ explorând procesele care au loc la interfața dintre un conductor electronic (metal sau semiconductor) și un conductor ionic (electrolit).
Pentru a înțelege funcționarea celulelor electrochimice‚ este esențial să se familiarizeze cu câteva concepte fundamentale. Acestea includ⁚ celula electrochimică‚ anodi și catodi‚ electrolitul‚ reacțiile de oxidare-reducere‚ forța electromotoare (FEM)‚ diferența de potențial‚ legea lui Faraday și ecuația lui Nernst.
2.Celula electrochimică
2.Anodi și catodi
2.Electrolitul
2.4. Reacții de oxidare-reducere
2.5. Forța electromotoare (FEM) și diferența de potențial
2.6; Legea lui Faraday
2.7. Ecuația lui Nernst
Celule galvanice (voltaic)
1.Definiție
1.Istoria celulelor galvanice
1.2.Stiva voltaică
1.2.Celula Daniell
1.2.Celula Leclanché
1.Aplicații ale celulelor galvanice
2.Definiție
2.Tipuri de baterii
2.Caracteristicile bateriilor
2.4. Aplicații ale bateriilor
3.Definiție
3.Principiul de funcționare
3.Tipuri de celule de combustie
3.4. Aplicații ale celulelor de combustie
2.Electroliză
2.Electrochimia în procesele industriale
Electrochimia este o ramură a chimiei care studiază relația dintre reacțiile chimice și energia electrică. Această disciplină se concentrează pe conversia energiei chimice în energie electrică și invers‚ explorând procesele care au loc la interfața dintre un conductor electronic (metal sau semiconductor) și un conductor ionic (electrolit).
Pentru a înțelege funcționarea celulelor electrochimice‚ este esențial să se familiarizeze cu câteva concepte fundamentale. Acestea includ⁚ celula electrochimică‚ anodi și catodi‚ electrolitul‚ reacțiile de oxidare-reducere‚ forța electromotoare (FEM)‚ diferența de potențial‚ legea lui Faraday și ecuația lui Nernst.
2.Celula electrochimică
O celulă electrochimică este un dispozitiv care transformă energia chimică în energie electrică sau invers‚ prin intermediul unei reacții de oxidare-reducere. Această celulă este formată din doi electrozi (anodul și catodul) scufundați într-un electrolit‚ care permite conducerea curentului ionic.
2.Anodi și catodi
2.Electrolitul
2.4. Reacții de oxidare-reducere
2.5. Forța electromotoare (FEM) și diferența de potențial
2.6. Legea lui Faraday
2.7. Ecuația lui Nernst
Celule galvanice (voltaic)
1.Definiție
1.Istoria celulelor galvanice
1.2.Stiva voltaică
1.2.Celula Daniell
1.2.Celula Leclanché
1.Aplicații ale celulelor galvanice
2.Definiție
2.Tipuri de baterii
2.Caracteristicile bateriilor
2.4. Aplicații ale bateriilor
3.Definiție
3.Principiul de funcționare
3.Tipuri de celule de combustie
3.4. Aplicații ale celulelor de combustie
2.Electroliză
2.Electrochimia în procesele industriale
Electrochimia este o ramură a chimiei care studiază relația dintre reacțiile chimice și energia electrică. Această disciplină se concentrează pe conversia energiei chimice în energie electrică și invers‚ explorând procesele care au loc la interfața dintre un conductor electronic (metal sau semiconductor) și un conductor ionic (electrolit).
Pentru a înțelege funcționarea celulelor electrochimice‚ este esențial să se familiarizeze cu câteva concepte fundamentale. Acestea includ⁚ celula electrochimică‚ anodi și catodi‚ electrolitul‚ reacțiile de oxidare-reducere‚ forța electromotoare (FEM)‚ diferența de potențial‚ legea lui Faraday și ecuația lui Nernst.
2.Celula electrochimică
O celulă electrochimică este un dispozitiv care transformă energia chimică în energie electrică sau invers‚ prin intermediul unei reacții de oxidare-reducere. Această celulă este formată din doi electrozi (anodul și catodul) scufundați într-un electrolit‚ care permite conducerea curentului ionic.
2.Anodi și catodi
Anodi și catodi sunt cele două componente principale ale unei celule electrochimice. Anodi este electrodul unde are loc oxidarea‚ adică pierderea electronilor. Catodul este electrodul unde are loc reducerea‚ adică câștigarea electronilor. În celulele galvanice‚ anodi este electrodul negativ‚ iar catodul este electrodul pozitiv.
2.Electrolitul
2.4. Reacții de oxidare-reducere
2.5. Forța electromotoare (FEM) și diferența de potențial
2.6. Legea lui Faraday
2.7. Ecuația lui Nernst
Celule galvanice (voltaic)
1.Definiție
1.Istoria celulelor galvanice
1.2.Stiva voltaică
1.2.Celula Daniell
1.2.Celula Leclanché
1.Aplicații ale celulelor galvanice
2.Definiție
2.Tipuri de baterii
2.Caracteristicile bateriilor
2.4. Aplicații ale bateriilor
3.Definiție
3.Principiul de funcționare
3.Tipuri de celule de combustie
3.4. Aplicații ale celulelor de combustie
2.Electroliză
2.Electrochimia în procesele industriale
Electrochimia este o ramură a chimiei care studiază relația dintre reacțiile chimice și energia electrică. Această disciplină se concentrează pe conversia energiei chimice în energie electrică și invers‚ explorând procesele care au loc la interfața dintre un conductor electronic (metal sau semiconductor) și un conductor ionic (electrolit).
Pentru a înțelege funcționarea celulelor electrochimice‚ este esențial să se familiarizeze cu câteva concepte fundamentale. Acestea includ⁚ celula electrochimică‚ anodi și catodi‚ electrolitul‚ reacțiile de oxidare-reducere‚ forța electromotoare (FEM)‚ diferența de potențial‚ legea lui Faraday și ecuația lui Nernst.
2.Celula electrochimică
O celulă electrochimică este un dispozitiv care transformă energia chimică în energie electrică sau invers‚ prin intermediul unei reacții de oxidare-reducere. Această celulă este formată din doi electrozi (anodul și catodul) scufundați într-un electrolit‚ care permite conducerea curentului ionic.
2.Anodi și catodi
Anodi și catodi sunt cele două componente principale ale unei celule electrochimice. Anodi este electrodul unde are loc oxidarea‚ adică pierderea electronilor. Catodul este electrodul unde are loc reducerea‚ adică câștigarea electronilor. În celulele galvanice‚ anodi este electrodul negativ‚ iar catodul este electrodul pozitiv.
2.Electrolitul
Electrolitul este o substanță care conduce curentul electric prin intermediul ionilor. Acesta poate fi o soluție ionică‚ o topitură ionică sau un material solid ionic. Rolul electrolitului este de a permite migrarea ionilor între electrozi‚ asigurând continuitatea circuitului electric.
2.4. Reacții de oxidare-reducere
2.5. Forța electromotoare (FEM) și diferența de potențial
2.6. Legea lui Faraday
2.7. Ecuația lui Nernst
Celule galvanice (voltaic)
1.Definiție
1.Istoria celulelor galvanice
1.2.Stiva voltaică
1.2.Celula Daniell
1.2.Celula Leclanché
1.Aplicații ale celulelor galvanice
2.Definiție
2.Tipuri de baterii
2.Caracteristicile bateriilor
2.4. Aplicații ale bateriilor
3.Definiție
3.Principiul de funcționare
3.Tipuri de celule de combustie
3.4. Aplicații ale celulelor de combustie
2.Electroliză
2.Electrochimia în procesele industriale
Electrochimia este o ramură a chimiei care studiază relația dintre reacțiile chimice și energia electrică. Această disciplină se concentrează pe conversia energiei chimice în energie electrică și invers‚ explorând procesele care au loc la interfața dintre un conductor electronic (metal sau semiconductor) și un conductor ionic (electrolit).
Pentru a înțelege funcționarea celulelor electrochimice‚ este esențial să se familiarizeze cu câteva concepte fundamentale. Acestea includ⁚ celula electrochimică‚ anodi și catodi‚ electrolitul‚ reacțiile de oxidare-reducere‚ forța electromotoare (FEM)‚ diferența de potențial‚ legea lui Faraday și ecuația lui Nernst.
2.Celula electrochimică
O celulă electrochimică este un dispozitiv care transformă energia chimică în energie electrică sau invers‚ prin intermediul unei reacții de oxidare-reducere. Această celulă este formată din doi electrozi (anodul și catodul) scufundați într-un electrolit‚ care permite conducerea curentului ionic.
2.Anodi și catodi
Anodi și catodi sunt cele două componente principale ale unei celule electrochimice. Anodi este electrodul unde are loc oxidarea‚ adică pierderea electronilor. Catodul este electrodul unde are loc reducerea‚ adică câștigarea electronilor. În celulele galvanice‚ anodi este electrodul negativ‚ iar catodul este electrodul pozitiv.
2.Electrolitul
Electrolitul este o substanță care conduce curentul electric prin intermediul ionilor. Acesta poate fi o soluție ionică‚ o topitură ionică sau un material solid ionic. Rolul electrolitului este de a permite migrarea ionilor între electrozi‚ asigurând continuitatea circuitului electric.
2.4. Reacții de oxidare-reducere
Reacțiile de oxidare-reducere (redox) sunt esențiale pentru funcționarea celulelor electrochimice. Oxidarea implică pierderea electronilor‚ în timp ce reducerea implică câștigarea electronilor. Într-o celulă galvanică‚ oxidarea are loc la anod‚ iar reducerea la catod.
2.5. Forța electromotoare (FEM) și diferența de potențial
2.6. Legea lui Faraday
2.7. Ecuația lui Nernst
Celule galvanice (voltaic)
1.Definiție
1.Istoria celulelor galvanice
1.2.Stiva voltaică
1.2.Celula Daniell
1.2.Celula Leclanché
1.Aplicații ale celulelor galvanice
2.Definiție
2.Tipuri de baterii
2.Caracteristicile bateriilor
2;4. Aplicații ale bateriilor
3.Definiție
3.Principiul de funcționare
3.Tipuri de celule de combustie
3.4. Aplicații ale celulelor de combustie
2.Electroliză
2.Electrochimia în procesele industriale
Electrochimia este o ramură a chimiei care studiază relația dintre reacțiile chimice și energia electrică. Această disciplină se concentrează pe conversia energiei chimice în energie electrică și invers‚ explorând procesele care au loc la interfața dintre un conductor electronic (metal sau semiconductor) și un conductor ionic (electrolit).
Pentru a înțelege funcționarea celulelor electrochimice‚ este esențial să se familiarizeze cu câteva concepte fundamentale. Acestea includ⁚ celula electrochimică‚ anodi și catodi‚ electrolitul‚ reacțiile de oxidare-reducere‚ forța electromotoare (FEM)‚ diferența de potențial‚ legea lui Faraday și ecuația lui Nernst.
2.Celula electrochimică
O celulă electrochimică este un dispozitiv care transformă energia chimică în energie electrică sau invers‚ prin intermediul unei reacții de oxidare-reducere. Această celulă este formată din doi electrozi (anodul și catodul) scufundați într-un electrolit‚ care permite conducerea curentului ionic.
2.Anodi și catodi
Anodi și catodi sunt cele două componente principale ale unei celule electrochimice. Anodi este electrodul unde are loc oxidarea‚ adică pierderea electronilor. Catodul este electrodul unde are loc reducerea‚ adică câștigarea electronilor. În celulele galvanice‚ anodi este electrodul negativ‚ iar catodul este electrodul pozitiv.
2.Electrolitul
Electrolitul este o substanță care conduce curentul electric prin intermediul ionilor. Acesta poate fi o soluție ionică‚ o topitură ionică sau un material solid ionic. Rolul electrolitului este de a permite migrarea ionilor între electrozi‚ asigurând continuitatea circuitului electric.
2.4. Reacții de oxidare-reducere
Reacțiile de oxidare-reducere (redox) sunt esențiale pentru funcționarea celulelor electrochimice. Oxidarea implică pierderea electronilor‚ în timp ce reducerea implică câștigarea electronilor. Într-o celulă galvanică‚ oxidarea are loc la anod‚ iar reducerea la catod.
2.5. Forța electromotoare (FEM) și diferența de potențial
Forța electromotoare (FEM) este diferența de potențial electric dintre cei doi electrozi ai unei celule electrochimice. Această diferență de potențial este cauzată de tendința naturală a electronilor de a se deplasa de la electrodul cu potențial mai scăzut la electrodul cu potențial mai ridicat. FEM-ul este o măsură a energiei disponibile din reacția chimică care are loc în celulă.
2.6. Legea lui Faraday
2.7. Ecuația lui Nernst
Celule galvanice (voltaic)
1.Definiție
1.Istoria celulelor galvanice
1.2.Stiva voltaică
1.2.Celula Daniell
1.2.Celula Leclanché
1.Aplicații ale celulelor galvanice
2.Definiție
2.Tipuri de baterii
2.Caracteristicile bateriilor
2.4. Aplicații ale bateriilor
3.Definiție
3.Principiul de funcționare
3.Tipuri de celule de combustie
3.4. Aplicații ale celulelor de combustie
2.Electroliză
2.Electrochimia în procesele industriale
Electrochimia este o ramură a chimiei care studiază relația dintre reacțiile chimice și energia electrică. Această disciplină se concentrează pe conversia energiei chimice în energie electrică și invers‚ explorând procesele care au loc la interfața dintre un conductor electronic (metal sau semiconductor) și un conductor ionic (electrolit).
Pentru a înțelege funcționarea celulelor electrochimice‚ este esențial să se familiarizeze cu câteva concepte fundamentale. Acestea includ⁚ celula electrochimică‚ anodi și catodi‚ electrolitul‚ reacțiile de oxidare-reducere‚ forța electromotoare (FEM)‚ diferența de potențial‚ legea lui Faraday și ecuația lui Nernst.
2.Celula electrochimică
O celulă electrochimică este un dispozitiv care transformă energia chimică în energie electrică sau invers‚ prin intermediul unei reacții de oxidare-reducere. Această celulă este formată din doi electrozi (anodul și catodul) scufundați într-un electrolit‚ care permite conducerea curentului ionic.
2.Anodi și catodi
Anodi și catodi sunt cele două componente principale ale unei celule electrochimice. Anodi este electrodul unde are loc oxidarea‚ adică pierderea electronilor. Catodul este electrodul unde are loc reducerea‚ adică câștigarea electronilor. În celulele galvanice‚ anodi este electrodul negativ‚ iar catodul este electrodul pozitiv.
2.Electrolitul
Electrolitul este o substanță care conduce curentul electric prin intermediul ionilor. Acesta poate fi o soluție ionică‚ o topitură ionică sau un material solid ionic. Rolul electrolitului este de a permite migrarea ionilor între electrozi‚ asigurând continuitatea circuitului electric.
2.4. Reacții de oxidare-reducere
Reacțiile de oxidare-reducere (redox) sunt esențiale pentru funcționarea celulelor electrochimice. Oxidarea implică pierderea electronilor‚ în timp ce reducerea implică câștigarea electronilor. Într-o celulă galvanică‚ oxidarea are loc la anod‚ iar reducerea la catod.
2.5. Forța electromotoare (FEM) și diferența de potențial
Forța electromotoare (FEM) este diferența de potențial electric dintre cei doi electrozi ai unei celule electrochimice. Această diferență de potențial este cauzată de tendința naturală a electronilor de a se deplasa de la electrodul cu potențial mai scăzut la electrodul cu potențial mai ridicat. FEM-ul este o măsură a energiei disponibile din reacția chimică care are loc în celulă.
2.6. Legea lui Faraday
Legea lui Faraday stabilește relația dintre cantitatea de substanță depusă sau eliberată la un electrod și cantitatea de electricitate care a trecut prin celulă. Această lege enunță că masa unei substanțe depuse sau eliberate la un electrod este direct proporțională cu cantitatea de electricitate care a trecut prin celulă. Matematic‚ legea lui Faraday se exprimă prin formula⁚ $$m = rac{MIt}{nF}$$‚ unde m este masa substanței depuse sau eliberate‚ M este masa molară a substanței‚ I este intensitatea curentului electric‚ t este timpul de trecere a curentului‚ n este numărul de electroni implicați în reacția redox‚ iar F este constanta lui Faraday.
2.7. Ecuația lui Nernst
Celule galvanice (voltaic)
1.Definiție
1.Istoria celulelor galvanice
1.2.Stiva voltaică
1.2.Celula Daniell
1.2.Celula Leclanché
1.Aplicații ale celulelor galvanice
2.Definiție
2.Tipuri de baterii
2.Caracteristicile bateriilor
2.4. Aplicații ale bateriilor
3.Definiție
3.Principiul de funcționare
3.Tipuri de celule de combustie
3.4. Aplicații ale celulelor de combustie
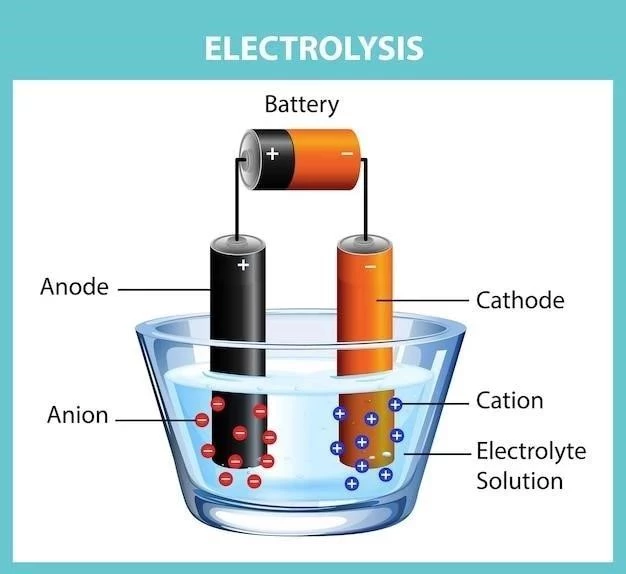
2.Electroliză
2.Electrochimia în procesele industriale
Introducere în electrochimie
Electrochimia⁚ Interfața dintre chimie și electricitate
Electrochimia este o ramură a chimiei care studiază relația dintre reacțiile chimice și energia electrică. Această disciplină se concentrează pe conversia energiei chimice în energie electrică și invers‚ explorând procesele care au loc la interfața dintre un conductor electronic (metal sau semiconductor) și un conductor ionic (electrolit).
Concepte fundamentale
Pentru a înțelege funcționarea celulelor electrochimice‚ este esențial să se familiarizeze cu câteva concepte fundamentale. Acestea includ⁚ celula electrochimică‚ anodi și catodi‚ electrolitul‚ reacțiile de oxidare-reducere‚ forța electromotoare (FEM)‚ diferența de potențial‚ legea lui Faraday și ecuația lui Nernst.
2.Celula electrochimică
O celulă electrochimică este un dispozitiv care transformă energia chimică în energie electrică sau invers‚ prin intermediul unei reacții de oxidare-reducere. Această celulă este formată din doi electrozi (anodul și catodul) scufundați într-un electrolit‚ care permite conducerea curentului ionic.
2.Anodi și catodi
Anodi și catodi sunt cele două componente principale ale unei celule electrochimice. Anodi este electrodul unde are loc oxidarea‚ adică pierderea electronilor. Catodul este electrodul unde are loc reducerea‚ adică câștigarea electronilor. În celulele galvanice‚ anodi este electrodul negativ‚ iar catodul este electrodul pozitiv.
2.Electrolitul
Electrolitul este o substanță care conduce curentul electric prin intermediul ionilor. Acesta poate fi o soluție ionică‚ o topitură ionică sau un material solid ionic. Rolul electrolitului este de a permite migrarea ionilor între electrozi‚ asigurând continuitatea circuitului electric.
2.4. Reacții de oxidare-reducere
Reacțiile de oxidare-reducere (redox) sunt esențiale pentru funcționarea celulelor electrochimice. Oxidarea implică pierderea electronilor‚ în timp ce reducerea implică câștigarea electronilor. Într-o celulă galvanică‚ oxidarea are loc la anod‚ iar reducerea la catod.
2.5. Forța electromotoare (FEM) și diferența de potențial
Forța electromotoare (FEM) este diferența de potențial electric dintre cei doi electrozi ai unei celule electrochimice. Această diferență de potențial este cauzată de tendința naturală a electronilor de a se deplasa de la electrodul cu potențial mai scăzut la electrodul cu potențial mai ridicat. FEM-ul este o măsură a energiei disponibile din reacția chimică care are loc în celulă.
2.6. Legea lui Faraday
Legea lui Faraday stabilește relația dintre cantitatea de substanță depusă sau eliberată la un electrod și cantitatea de electricitate care a trecut prin celulă. Această lege enunță că masa unei substanțe depuse sau eliberate la un electrod este direct proporțională cu cantitatea de electricitate care a trecut prin celulă. Matematic‚ legea lui Faraday se exprimă prin formula⁚ $$m = rac{MIt}{nF}$$‚ unde m este masa substanței depuse sau eliberate‚ M este masa molară a substanței‚ I este intensitatea curentului electric‚ t este timpul de trecere a curentului‚ n este numărul de electroni implicați în reacția redox‚ iar F este constanta lui Faraday.
2.7. Ecuația lui Nernst
Ecuația lui Nernst este o ecuație care descrie variația potențialului de electrod în funcție de concentrația reactanților și produșilor. Această ecuație este foarte importantă pentru determinarea potențialului de electrod într-o celulă electrochimică în condiții ne-standard‚ adică atunci când concentrația reactanților și produșilor diferă de concentrația standard. Ecuația lui Nernst are forma⁚ $$E = E^o ─ rac{RT}{nF}lnQ$$‚ unde E este potențialul de electrod‚ $E^o$ este potențialul standard de electrod‚ R este constanta universală a gazelor‚ T este temperatura absolută‚ n este numărul de electroni implicați în reacția redox‚ F este constanta lui Faraday‚ iar Q este coeficientul de reacție.
Articolul oferă o introducere utilă în electrochimie, punând accent pe aspectele fundamentale ale acestui domeniu. Explicațiile sunt clare și concise, iar exemplele practice facilitează înțelegerea conceptelor. O sugestie ar fi adăugarea unor diagrame sau ilustrații pentru a vizualiza mai bine procesele electrochimice, cum ar fi funcționarea celulelor galvanice sau a electrolizei. De asemenea, o secțiune dedicată aplicațiilor moderne ale electrochimiei, cum ar fi bateriile litiu-ion sau celulele de combustibil, ar fi de interes pentru cititor.
Articolul oferă o introducere utilă în electrochimie, punând accent pe aspectele fundamentale ale acestui domeniu. Explicațiile sunt clare și concise, iar exemplele practice facilitează înțelegerea conceptelor. O sugestie ar fi adăugarea unor exerciții practice la sfârșitul articolului, pentru a permite cititorului să testeze înțelegerea conceptelor prezentate. De asemenea, o secțiune dedicată unor aplicații ale electrochimiei în diverse domenii, cum ar fi medicina, agricultura sau industria alimentară, ar fi de interes pentru cititor.
Articolul este bine structurat și prezintă o imagine de ansamblu a electrochimiei, acoperind o gamă largă de subiecte, de la definiții de bază la aplicații industriale. Explicațiile sunt clare și concise, iar exemplele practice ajută la o mai bună înțelegere a conceptelor. Ar fi util să se includă o secțiune dedicată legăturii dintre electrochimie și alte discipline, cum ar fi chimia fizică, chimia analitică sau ingineria chimică. De asemenea, o discuție mai amplă despre impactul electrochimiei asupra societății ar fi de interes pentru cititor.
Articolul este bine structurat și prezintă o imagine de ansamblu a electrochimiei, acoperind o gamă largă de subiecte, de la definiții de bază la aplicații industriale. Explicațiile sunt clare și concise, iar exemplele practice ajută la o mai bună înțelegere a conceptelor. Ar fi util să se includă o secțiune dedicată istoriei electrochimiei, prezentând contribuțiile unor oameni de știință importanți din acest domeniu. De asemenea, o discuție mai amplă despre impactul electrochimiei asupra societății ar fi de interes pentru cititor.
Articolul prezintă o introducere clară și concisă în electrochimie, acoperind o gamă largă de subiecte. Explicațiile sunt ușor de înțeles, iar exemplele practice ajută la o mai bună înțelegere a conceptelor. O sugestie ar fi adăugarea unor referințe bibliografice la sfârșitul articolului, pentru a permite cititorului să aprofundeze anumite subiecte de interes. De asemenea, o secțiune dedicată unor probleme actuale din domeniul electrochimiei, cum ar fi dezvoltarea unor baterii cu densitate energetică mai mare sau a unor tehnologii de stocare a energiei solare, ar fi de interes pentru cititor.
Articolul prezintă o introducere concisă și clară în domeniul electrochimiei, acoperind o gamă largă de subiecte, de la celulele galvanice și baterii la electroliză și aplicațiile industriale. Structura este logică, iar informația este prezentată într-un mod accesibil, cu exemple relevante. Totuși, ar fi benefic să se includă o secțiune dedicată terminologiei specifice, cu definiții clare ale unor termeni precum „electrod”, „anod”, „catod” și „electrolit”. De asemenea, o prezentare mai detaliată a ecuației lui Nernst ar îmbunătăți valoarea didactică a articolului.