Proprietățile grupelor din tabelul periodic al elementelor

Proprietățile grupelor din tabelul periodic al elementelor
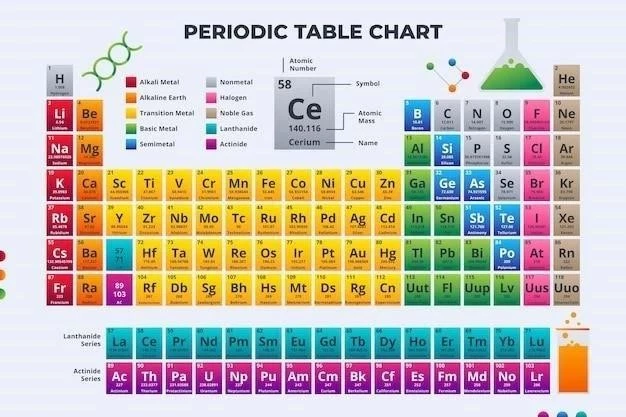
Tabelul periodic al elementelor este o reprezentare organizată a tuturor elementelor chimice cunoscute, aranjate în funcție de numărul atomic crescător și de proprietățile lor chimice recurente․ Această organizare permite o înțelegere mai profundă a relațiilor dintre elemente și a comportamentului lor în reacțiile chimice․
Introducere
Tabelul periodic al elementelor este un instrument esențial în chimia modernă, oferind o reprezentare sistematică și organizată a tuturor elementelor chimice cunoscute․ Această organizare se bazează pe proprietățile chimice recurente ale elementelor, reflectând tendințele periodice ale proprietăților atomice; Tabelul periodic este structurat în funcție de numărul atomic crescător, aranjând elementele cu proprietăți similare în coloane verticale numite grupe și în rânduri orizontale numite perioade․ Această aranjare permite o înțelegere mai profundă a relațiilor dintre elemente și a comportamentului lor în reacțiile chimice․
Proprietățile elementelor variază în mod predictibil în funcție de poziția lor în tabelul periodic․ De exemplu, elementele din aceeași grupă au tendința de a avea proprietăți chimice similare, datorită numărului identic de electroni de valență․ Elementele din aceeași perioadă prezintă o variație sistematică a proprietăților, reflectând modificările configurației electronice a atomilor․ Această periodicitate permite predicția comportamentului chimic al elementelor și dezvoltarea unor modele teoretice pentru a explica legăturile chimice și reacțiile․
Organizarea tabelului periodic
Tabelul periodic al elementelor este organizat în funcție de numărul atomic crescător, reflectând numărul de protoni din nucleul atomului․ Această organizare sistematică permite o înțelegere mai profundă a relațiilor dintre elemente și a comportamentului lor în reacțiile chimice․ Elementele cu proprietăți chimice similare sunt grupate în coloane verticale numite grupe, iar elementele cu număr similar de straturi electronice sunt aranjate în rânduri orizontale numite perioade․
Grupele sunt numerotate de la 1 la 18, cu excepția grupelor 3-12, care sunt considerate metale de tranziție․ Elementele din aceeași grupă au același număr de electroni de valență, adică electronii din ultimul strat electronic, ceea ce le conferă proprietăți chimice similare․ De exemplu, metalele alcaline din grupa 1 au un singur electron de valență, ceea ce le face foarte reactive․ Perioadele sunt numerotate de la 1 la 7, reflectând numărul de straturi electronice ale atomilor․ Elementele din aceeași perioadă au același număr de straturi electronice, dar numărul de electroni de valență variază․
Grupe și perioade
Tabelul periodic este organizat în coloane verticale numite grupe și rânduri orizontale numite perioade․ Grupele sunt numerotate de la 1 la 18, cu excepția grupelor 3-12, care sunt considerate metale de tranziție․ Elementele din aceeași grupă au același număr de electroni de valență, adică electronii din ultimul strat electronic, ceea ce le conferă proprietăți chimice similare․ De exemplu, metalele alcaline din grupa 1 au un singur electron de valență, ceea ce le face foarte reactive․
Perioadele sunt numerotate de la 1 la 7, reflectând numărul de straturi electronice ale atomilor․ Elementele din aceeași perioadă au același număr de straturi electronice, dar numărul de electroni de valență variază․ De-a lungul unei perioade, raza atomică scade, electronegativitatea crește, iar energia de ionizare crește, deoarece atracția nucleară crește․
Această organizare sistematică a elementelor în grupe și perioade permite o înțelegere mai profundă a relațiilor dintre elemente și a comportamentului lor în reacțiile chimice․
Numere atomice și configurații electronice
Fiecare element din tabelul periodic este identificat printr-un număr atomic unic, care reprezintă numărul de protoni din nucleul atomului․ Numărul atomic determină și numărul de electroni din atomul neutru․ Configurația electronică a unui atom descrie modul în care electronii sunt aranjați în jurul nucleului, în diferite niveluri de energie și subnivele․ Configurația electronică este crucială pentru înțelegerea proprietăților chimice ale unui element, deoarece electronii de valență, cei din ultimul strat electronic, sunt cei care participă la formarea legăturilor chimice․
De exemplu, elementul carbon (C) are numărul atomic 6 și configurația electronică $1s^22s^22p^2$․ Această configurație indică faptul că carbonul are 4 electroni de valență, ceea ce îi permite să formeze 4 legături covalente, explicând de ce carbonul formează o gamă largă de compuși organici․
Prin analiza configurațiilor electronice, putem prezice și explica tendințele proprietăților chimice ale elementelor din tabelul periodic․
Tendințele proprietăților chimice
Aranjarea elementelor în tabelul periodic nu este întâmplătoare, ci reflectă tendințele recurente ale proprietăților chimice․ Aceste tendințe sunt determinate de modificările configurației electronice a atomilor pe măsură ce ne deplasăm de-a lungul perioadelor și grupelor din tabel․ Proprietățile chimice importante care prezintă tendințe includ⁚
- Electronegativitatea⁚ Măsura capacității unui atom de a atrage electroni într-o legătură chimică․ Electronegativitatea crește de-a lungul perioadelor și scade în josul grupelor․
- Energia de ionizare⁚ Energia necesară pentru a îndepărta un electron dintr-un atom neutru în faza gazoasă․ Energia de ionizare crește de-a lungul perioadelor și scade în josul grupelor․
- Raza atomică⁚ Distanța medie dintre nucleul atomului și electronul cel mai exterior․ Raza atomică scade de-a lungul perioadelor și crește în josul grupelor․
- Caracterul metalic⁚ Tendința unui element de a pierde electroni și de a forma cationi․ Caracterul metalic crește în josul grupelor și scade de-a lungul perioadelor․
Aceste tendințe ne ajută să înțelegem cum se comportă elementele în reacțiile chimice și ne permit să prezicem proprietățile unor elemente necunoscute․
Electronegativitatea
Electronegativitatea este o măsură a capacității unui atom de a atrage electroni într-o legătură chimică․ Cu cât un atom este mai electronegativ, cu atât mai puternic va atrage electronii din legăturile sale․ Această proprietate este importantă pentru a prezice tipul de legătură chimică care se va forma între doi atomi și pentru a înțelege polaritatea moleculelor․
Electronegativitatea crește de-a lungul perioadelor din tabelul periodic․ Aceasta se datorează faptului că, în cadrul unei perioade, numărul de protoni din nucleu crește, ceea ce duce la o atracție mai puternică a electronilor din învelișul exterior․ În același timp, raza atomică scade, ceea ce face ca electronii din învelișul exterior să fie mai aproape de nucleu și, prin urmare, mai atrași de acesta․
Electronegativitatea scade în josul grupelor din tabelul periodic․ Aceasta se datorează faptului că, în cadrul unui grup, numărul de niveluri de energie crește, ceea ce duce la o distanță mai mare între nucleu și electronii din învelișul exterior․ Astfel, atracția nucleului asupra electronilor este mai slabă․
Energia de ionizare
Energia de ionizare este energia minimă necesară pentru a elimina un electron dintr-un atom gazos în starea sa fundamentală, formând un ion pozitiv․ Această proprietate este o măsură a tendinței unui atom de a pierde un electron și de a forma un cation․ Cu cât energia de ionizare este mai mare, cu atât mai greu este de îndepărtat un electron de la atom․
Energia de ionizare crește de-a lungul perioadelor din tabelul periodic․ Aceasta se datorează faptului că, în cadrul unei perioade, numărul de protoni din nucleu crește, ceea ce duce la o atracție mai puternică a electronilor din învelișul exterior․ Astfel, este necesară mai multă energie pentru a îndepărta un electron․
Energia de ionizare scade în josul grupelor din tabelul periodic․ Aceasta se datorează faptului că, în cadrul unui grup, numărul de niveluri de energie crește, ceea ce duce la o distanță mai mare între nucleu și electronii din învelișul exterior․ Astfel, atracția nucleului asupra electronilor este mai slabă și este necesară mai puțină energie pentru a îndepărta un electron․
Raza atomică
Raza atomică este o măsură a dimensiunii unui atom․ Este definită ca jumătate din distanța dintre nucleele a doi atomi identici legați covalent․ Raza atomică este o proprietate periodică, adică variază în mod regulat în funcție de poziția elementului în tabelul periodic․
Raza atomică scade de-a lungul perioadelor din tabelul periodic․ Aceasta se datorează faptului că, în cadrul unei perioade, numărul de protoni din nucleu crește, ceea ce duce la o atracție mai puternică a electronilor din învelișul exterior․ Astfel, electronii sunt trași mai aproape de nucleu, iar raza atomică scade․
Raza atomică crește în josul grupelor din tabelul periodic․ Aceasta se datorează faptului că, în cadrul unui grup, numărul de niveluri de energie crește, ceea ce duce la o distanță mai mare între nucleu și electronii din învelișul exterior․ Astfel, electronii sunt mai departe de nucleu, iar raza atomică crește․
Caracterul metalic
Caracterul metalic este o măsură a tendinței unui element de a pierde electroni și de a forma ioni pozitivi (cationi)․ Este o proprietate periodică, adică variază în mod regulat în funcție de poziția elementului în tabelul periodic․
Caracterul metalic crește în josul grupelor din tabelul periodic․ Aceasta se datorează faptului că, în cadrul unui grup, electronii din învelișul exterior sunt mai departe de nucleu și, prin urmare, sunt mai ușor de îndepărtat․ Astfel, elementele din partea de jos a grupelor au un caracter metalic mai pronunțat․
Caracterul metalic scade de-a lungul perioadelor din tabelul periodic․ Aceasta se datorează faptului că, în cadrul unei perioade, atracția nucleului asupra electronilor din învelișul exterior crește, ceea ce face ca aceștia să fie mai greu de îndepărtat․ Astfel, elementele din partea dreaptă a perioadelor au un caracter metalic mai scăzut․
Proprietățile grupelor specifice
Fiecare grup din tabelul periodic prezintă proprietăți chimice specifice, determinate de configurația electronică a elementelor din acel grup․ Aceste proprietăți unice permit clasificarea elementelor în categorii distincte, cu caracteristici și reacții specifice․
De exemplu, metalele alcaline (grupul 1) sunt elemente reactive, cu o tendință puternică de a pierde un electron din învelișul exterior pentru a forma cationi cu sarcina +1․ Metalele alcalino-pământoase (grupul 2) sunt, de asemenea, reactive, dar mai puțin decât metalele alcaline, pierzând doi electroni din învelișul exterior pentru a forma cationi cu sarcina +2․
Halogenii (grupul 17) sunt elemente nemetalice, cu o tendință puternică de a câștiga un electron pentru a forma anioni cu sarcina -1․ Gaze nobile (grupul 18) sunt elemente foarte stabile, cu o configurație electronică completă, ceea ce le face foarte puțin reactive․
Metalele alcaline
Metalele alcaline, situate în grupa 1 a tabelului periodic, sunt elemente reactive, cu o tendință puternică de a pierde un electron din învelișul exterior pentru a forma cationi cu sarcina +1․ Această tendință este explicată de configurația electronică a acestor elemente, care are un singur electron în învelișul de valență․ Deoarece electronul de valență este slab legat de nucleu, este ușor de îndepărtat, rezultând o energie de ionizare scăzută․
Metalele alcaline sunt moi, cu puncte de topire și fierbere scăzute, și sunt bune conductoare de căldură și electricitate․ Reacționează violent cu apa, eliberând hidrogen gazos, și formează compuși ionici cu nemetalele․ De asemenea, sunt foarte reactive cu oxigenul, formând oxizi․
Exemple de metale alcaline includ⁚ litiu (Li), sodiu (Na), potasiu (K), rubidiu (Rb), cesiu (Cs) și franciu (Fr)․ Aceste elemente sunt utilizate în diverse aplicații, inclusiv în baterii, lămpi, îngrășăminte și medicamente․
Metalele alcalino-pământoase
Metalele alcalino-pământoase, situate în grupa 2 a tabelului periodic, sunt elemente reactive, cu o tendință de a pierde doi electroni din învelișul exterior pentru a forma cationi cu sarcina +2․ Această tendință este explicată de configurația electronică a acestor elemente, care au doi electroni în învelișul de valență․ Deși energia de ionizare este mai mare decât cea a metalelor alcaline, acești electroni de valență sunt totuși relativ ușor de îndepărtat․
Metalele alcalino-pământoase sunt mai dure și au puncte de topire și fierbere mai ridicate decât metalele alcaline․ De asemenea, sunt mai puțin reactive cu apa, dar reacționează cu oxigenul, formând oxizi․ Aceste elemente sunt utilizate în diverse aplicații, inclusiv în fabricarea aliajelor, în industria ceramică și în producerea de lumină artificială․
Exemple de metale alcalino-pământoase includ⁚ beriliu (Be), magneziu (Mg), calciu (Ca), stronțiu (Sr), bariu (Ba) și radiu (Ra)․ Aceste elemente sunt esențiale pentru o varietate de procese biologice, cum ar fi contracția musculară și transmiterea impulsurilor nervoase․
Halogenii
Halogenii, grupa 17 a tabelului periodic, sunt un grup de elemente nemetalice caracterizate printr-o reactivitate ridicată․ Această reactivitate este explicată de tendința lor de a câștiga un electron pentru a forma anioni cu sarcina -1, completând astfel învelișul de valență și obținând o configurație electronică stabilă․ Această tendință este evidentă în electronegativitatea lor ridicată, care crește de sus în jos în grup․
Halogenii se găsesc în stare naturală sub formă de molecule diatomice, cum ar fi fluorul (F2), clorul (Cl2), bromul (Br2), iodul (I2) și astatul (At)․ Acești compuși sunt foarte reactivi și pot forma o varietate de compuși cu alte elemente․ De exemplu, clorul este utilizat pe scară largă în industria chimică pentru a produce o gamă largă de substanțe, inclusiv clorură de sodiu (sare de masă), PVC și clorură de polivinil․
Halogenii au o importanță vitală în biologie, fiind implicați în diverse procese, cum ar fi reglarea presiunii sanguine, sinteza proteinelor și funcționarea sistemului imunitar․ De asemenea, sunt utilizați în medicină pentru a dezinfecta și a trata diverse afecțiuni․
Gaze nobile
Gaze nobile, cunoscute și sub denumirea de gaze inerte, formează grupa 18 a tabelului periodic․ Aceste elemente se caracterizează printr-o reactivitate chimică extrem de scăzută, datorită configurației lor electronice stabile, cu un înveliș de valență complet ocupat․ Această stabilitate face ca gazele nobile să fie relativ inerte în condiții normale․
Elementele din grupa gazelor nobile sunt heliu (He), neon (Ne), argon (Ar), kripton (Kr), xenon (Xe) și radon (Rn)․ Aceste gaze sunt incolore, inodore și insipide în condiții standard․ Ele se găsesc în atmosferă în concentrații scăzute, cu excepția heliului, care este abundent în univers․
În trecut, gazele nobile erau considerate a fi complet inerte, dar în ultimii ani s-au descoperit compuși ai xenonului și ai radonului, demonstrând că aceste elemente pot participa la reacții chimice․ Cu toate acestea, reactivitatea lor rămâne foarte limitată, făcându-le utile în diverse aplicații, cum ar fi iluminatul, laserele și imagistica medicală․
Articolul prezintă o introducere clară și concisă a conceptului de tabel periodic al elementelor, evidențiind importanța sa în chimia modernă. Explicarea organizării tabelului periodic în funcție de numărul atomic și de proprietățile chimice recurente este bine structurată și ușor de înțeles. De asemenea, articolul subliniază importanța proprietăților periodice ale elementelor, oferind exemple relevante pentru a ilustra variația predictibilă a proprietăților în funcție de poziția în tabelul periodic.
Articolul prezintă o abordare sistematică a conceptului de tabel periodic al elementelor, evidențiind organizarea sa în funcție de numărul atomic crescător și de proprietățile chimice recurente. Explicația este clară și concisă, oferind o înțelegere profundă a relațiilor dintre elemente și a comportamentului lor în reacțiile chimice. De asemenea, articolul subliniază importanța proprietăților periodice ale elementelor, oferind exemple relevante pentru a ilustra variația predictibilă a proprietăților în funcție de poziția în tabelul periodic.
Articolul prezintă o abordare sistematică a conceptului de tabel periodic al elementelor, evidențiând organizarea sa în funcție de numărul atomic crescător și de proprietățile chimice recurente. Explicația este clară și concisă, oferind o înțelegere profundă a relațiilor dintre elemente și a comportamentului lor în reacțiile chimice. De asemenea, articolul subliniază importanța proprietăților periodice ale elementelor, oferind exemple relevante pentru a ilustra variația predictibilă a proprietăților în funcție de poziția în tabelul periodic.
Articolul prezintă o analiză clară și concisă a organizării tabelului periodic al elementelor, evidențiând importanța sa în chimia modernă. Explicația organizării tabelului periodic în funcție de numărul atomic și de proprietățile chimice recurente este bine structurată și ușor de înțeles. De asemenea, articolul subliniază importanța proprietăților periodice ale elementelor, oferind exemple relevante pentru a ilustra variația predictibilă a proprietăților în funcție de poziția în tabelul periodic.
Articolul oferă o prezentare clară și concisă a conceptului de tabel periodic al elementelor, evidențiând importanța sa în chimia modernă. Explicația organizării tabelului periodic în funcție de numărul atomic și de proprietățile chimice recurente este bine structurată și ușor de înțeles. De asemenea, articolul subliniază importanța proprietăților periodice ale elementelor, oferind exemple relevante pentru a ilustra variația predictibilă a proprietăților în funcție de poziția în tabelul periodic.
Articolul oferă o introducere excelentă în conceptul de tabel periodic al elementelor, evidențiind importanța sa în chimia modernă. Explicația organizării tabelului periodic în funcție de numărul atomic și de proprietățile chimice recurente este bine structurată și ușor de înțeles. De asemenea, articolul subliniază importanța proprietăților periodice ale elementelor, oferind exemple relevante pentru a ilustra variația predictibilă a proprietăților în funcție de poziția în tabelul periodic.
Articolul oferă o introducere excelentă în conceptul de tabel periodic al elementelor, evidențiând importanța sa în chimia modernă. Explicația organizării tabelului periodic în funcție de numărul atomic și de proprietățile chimice recurente este bine structurată și ușor de înțeles. De asemenea, articolul subliniază importanța proprietăților periodice ale elementelor, oferind exemple relevante pentru a ilustra variația predictibilă a proprietăților în funcție de poziția în tabelul periodic.
Articolul prezintă o introducere concisă și clară a conceptului de tabel periodic al elementelor, evidențiând importanța sa în chimia modernă. Explicația organizării tabelului periodic în funcție de numărul atomic și de proprietățile chimice recurente este bine structurată și ușor de înțeles. De asemenea, articolul subliniază importanța proprietăților periodice ale elementelor, oferind exemple relevante pentru a ilustra variația predictibilă a proprietăților în funcție de poziția în tabelul periodic.
Articolul prezintă o introducere clară și concisă a conceptului de tabel periodic al elementelor, evidențiând importanța sa în chimia modernă. Explicarea organizării tabelului periodic în funcție de numărul atomic și de proprietățile chimice recurente este bine structurată și ușor de înțeles. De asemenea, articolul subliniază importanța proprietăților periodice ale elementelor, oferind exemple relevante pentru a ilustra variația predictibilă a proprietăților în funcție de poziția în tabelul periodic.