Structura Atomică și Configurația Electronică
2.Numerele Cuantice
2.Orbitalii Atomici
2.Nivelurile de Energie și Subnivelele
3.Principiul Aufbau
3.Regula lui Hund
3.Principiul Excluderii Pauli
Un subnivel este un set de orbitali atomici cu același număr cuantic principal (n) și același număr cuantic azimutal (l).
2.Numerele Cuantice
2.Orbitalii Atomici
2.Nivelurile de Energie și Subnivelele
3.Principiul Aufbau
3.Regula lui Hund
3.Principiul Excluderii Pauli
Un subnivel este un set de orbitali atomici cu același număr cuantic principal (n) și același număr cuantic azimutal (l).
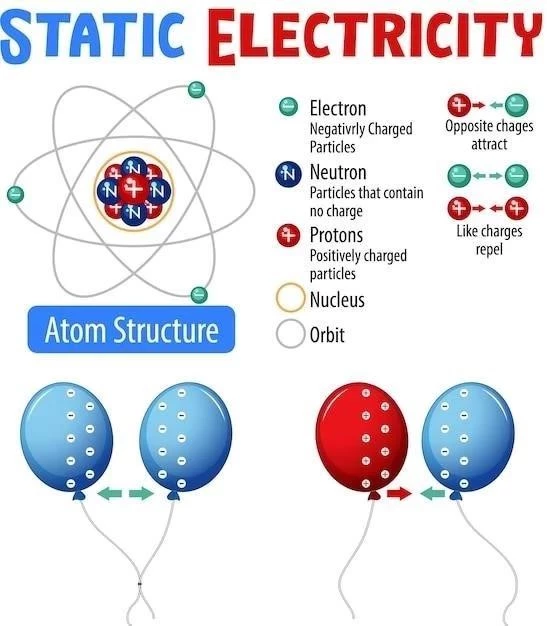
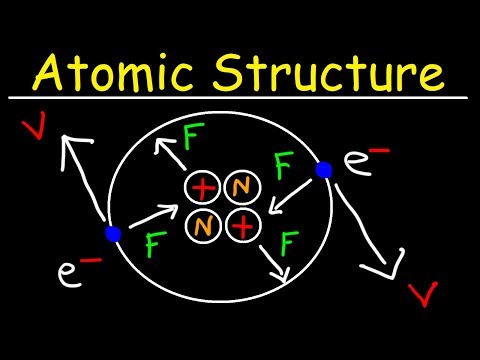
Atomul este unitatea fundamentală a materiei, constând dintr-un nucleu central, format din protoni și neutroni, înconjurat de electroni. Structura atomică descrie aranjarea acestor particule subatomice și interacțiunile dintre ele. Înțelegerea structurii atomice este esențială pentru a explica proprietățile chimice ale elementelor și pentru a prezice comportamentul lor în reacțiile chimice.
Modelul atomic cuantic, dezvoltat în secolul XX, oferă o descriere mai precisă a structurii atomice, utilizând concepte precum numerele cuantice, orbitalii atomici și nivelurile de energie. Numerele cuantice descriu proprietățile electronilor din atomi, cum ar fi energia și momentul unghiular. Orbitalii atomici sunt regiuni din spațiu în care există o probabilitate mare de a găsi un electron, iar nivelurile de energie descriu stările energetice posibile ale electronilor.
Configurația electronică a unui atom descrie distribuția electronilor în orbitalii atomici, oferind o imagine a structurii electronice a atomului. Această configurație este determinată de principiul Aufbau, regula lui Hund și principiul excluderii Pauli, care descriu modul în care electronii ocupă orbitalii atomici.
2.Numerele Cuantice
2.Orbitalii Atomici
2.Nivelurile de Energie și Subnivelele
3.Principiul Aufbau
3.Regula lui Hund
3.Principiul Excluderii Pauli
Un subnivel este un set de orbitali atomici cu același număr cuantic principal (n) și același număr cuantic azimutal (l).
Atomul este unitatea fundamentală a materiei, constând dintr-un nucleu central, format din protoni și neutroni, înconjurat de electroni. Structura atomică descrie aranjarea acestor particule subatomice și interacțiunile dintre ele. Înțelegerea structurii atomice este esențială pentru a explica proprietățile chimice ale elementelor și pentru a prezice comportamentul lor în reacțiile chimice.
Modelul atomic cuantic, dezvoltat în secolul XX, oferă o descriere mai precisă a structurii atomice, utilizând concepte precum numerele cuantice, orbitalii atomici și nivelurile de energie. Numerele cuantice descriu proprietățile electronilor din atomi, cum ar fi energia și momentul unghiular. Orbitalii atomici sunt regiuni din spațiu în care există o probabilitate mare de a găsi un electron, iar nivelurile de energie descriu stările energetice posibile ale electronilor.
Configurația electronică a unui atom descrie distribuția electronilor în orbitalii atomici, oferind o imagine a structurii electronice a atomului. Această configurație este determinată de principiul Aufbau, regula lui Hund și principiul excluderii Pauli, care descriu modul în care electronii ocupă orbitalii atomici.
Modelul atomic cuantic, dezvoltat de fizicieni precum Niels Bohr, Erwin Schrödinger și Werner Heisenberg, se bazează pe principiile mecanicii cuantice pentru a descrie comportamentul electronilor în atomi. Această teorie a revoluționat înțelegerea structurii atomice, oferind o explicație mai precisă a proprietăților atomilor și a spectrului lor de emisie.
În modelul atomic cuantic, electronii nu mai sunt considerați particule clasice care orbitează nucleul, ci mai degrabă ca unde staționare, descrise de funcții de undă. Aceste funcții de undă, soluții ale ecuației Schrödinger, descriu probabilitatea de a găsi un electron într-un anumit punct din spațiu. Fiecare funcție de undă este caracterizată de un set de numere cuantice, care descriu proprietățile electronului.
2.Numerele Cuantice
2.Orbitalii Atomici
2.Nivelurile de Energie și Subnivelele
3.Principiul Aufbau
3.Regula lui Hund
3.Principiul Excluderii Pauli
Un subnivel este un set de orbitali atomici cu același număr cuantic principal (n) și același număr cuantic azimutal (l).
Atomul este unitatea fundamentală a materiei, constând dintr-un nucleu central, format din protoni și neutroni, înconjurat de electroni. Structura atomică descrie aranjarea acestor particule subatomice și interacțiunile dintre ele. Înțelegerea structurii atomice este esențială pentru a explica proprietățile chimice ale elementelor și pentru a prezice comportamentul lor în reacțiile chimice.
Modelul atomic cuantic, dezvoltat în secolul XX, oferă o descriere mai precisă a structurii atomice, utilizând concepte precum numerele cuantice, orbitalii atomici și nivelurile de energie. Numerele cuantice descriu proprietățile electronilor din atomi, cum ar fi energia și momentul unghiular. Orbitalii atomici sunt regiuni din spațiu în care există o probabilitate mare de a găsi un electron, iar nivelurile de energie descriu stările energetice posibile ale electronilor.
Configurația electronică a unui atom descrie distribuția electronilor în orbitalii atomici, oferind o imagine a structurii electronice a atomului. Această configurație este determinată de principiul Aufbau, regula lui Hund și principiul excluderii Pauli, care descriu modul în care electronii ocupă orbitalii atomici.
Modelul atomic cuantic, dezvoltat de fizicieni precum Niels Bohr, Erwin Schrödinger și Werner Heisenberg, se bazează pe principiile mecanicii cuantice pentru a descrie comportamentul electronilor în atomi. Această teorie a revoluționat înțelegerea structurii atomice, oferind o explicație mai precisă a proprietăților atomilor și a spectrului lor de emisie.
În modelul atomic cuantic, electronii nu mai sunt considerați particule clasice care orbitează nucleul, ci mai degrabă ca unde staționare, descrise de funcții de undă. Aceste funcții de undă, soluții ale ecuației Schrödinger, descriu probabilitatea de a găsi un electron într-un anumit punct din spațiu. Fiecare funcție de undă este caracterizată de un set de numere cuantice, care descriu proprietățile electronului.
2.Numerele Cuantice
Numerele cuantice sunt un set de numere care descriu proprietățile electronilor din atomi, inclusiv energia, forma și orientarea spațială a orbitalilor atomici. Există patru tipuri principale de numere cuantice⁚
- Numărul cuantic principal (n)⁚ descrie nivelul de energie al electronului. Poate lua valori întregi pozitive, cum ar fi 1, 2, 3, etc., cu valori mai mari corespunzând nivelurilor de energie mai înalte. De exemplu, n=1 corespunde stării electronice fundamentale, n=2 corespunde primului nivel excitat, și așa mai departe.
- Numărul cuantic azimutal sau numărul cuantic al momentului unghiular (l)⁚ descrie forma orbitalului atomic și are valori cuprinse între 0 și n-l=0 corespunde unui orbital s, care este sferic, l=1 corespunde unui orbital p, care are forma de halteră, l=2 corespunde unui orbital d, care are o formă mai complexă, și așa mai departe.
- Numărul cuantic magnetic (ml)⁚ descrie orientarea spațială a orbitalului atomic. Poate lua valori întregi de la -l la +l, inclusiv 0. De exemplu, pentru l=1, ml poate lua valorile -1, 0, +1, corespunzând celor trei orbitali p orientate de-a lungul axelor x, y, și z.
- Numărul cuantic de spin (ms)⁚ descrie momentul unghiular intrinsec al electronului, cunoscut ca spin. Electronii au un spin intrinsec, care poate fi reprezentat ca o rotire pe o axă, iar spinul poate fi orientat în sus (ms=+1/2) sau în jos (ms=-1/2).
Numerele cuantice sunt interconectate și respectă anumite reguli. De exemplu, numărul cuantic principal (n) determină numărul de subnivele și de orbitali atomici posibili într-un atom. Numărul cuantic azimutal (l) determină forma orbitalului atomic, iar numărul cuantic magnetic (ml) determină orientarea spațială a orbitalului. Numerele cuantice sunt instrumente esențiale pentru înțelegerea structurii atomice și a comportamentului electronilor în atomi.
2.Numerele Cuantice
2.Orbitalii Atomici
2.Nivelurile de Energie și Subnivelele
3.Principiul Aufbau
3.Regula lui Hund
3.Principiul Excluderii Pauli
Un subnivel este un set de orbitali atomici cu același număr cuantic principal (n) și același număr cuantic azimutal (l).
Atomul este unitatea fundamentală a materiei, constând dintr-un nucleu central, format din protoni și neutroni, înconjurat de electroni. Structura atomică descrie aranjarea acestor particule subatomice și interacțiunile dintre ele. Înțelegerea structurii atomice este esențială pentru a explica proprietățile chimice ale elementelor și pentru a prezice comportamentul lor în reacțiile chimice.
Modelul atomic cuantic, dezvoltat în secolul XX, oferă o descriere mai precisă a structurii atomice, utilizând concepte precum numerele cuantice, orbitalii atomici și nivelurile de energie. Numerele cuantice descriu proprietățile electronilor din atomi, cum ar fi energia și momentul unghiular. Orbitalii atomici sunt regiuni din spațiu în care există o probabilitate mare de a găsi un electron, iar nivelurile de energie descriu stările energetice posibile ale electronilor.
Configurația electronică a unui atom descrie distribuția electronilor în orbitalii atomici, oferind o imagine a structurii electronice a atomului. Această configurație este determinată de principiul Aufbau, regula lui Hund și principiul excluderii Pauli, care descriu modul în care electronii ocupă orbitalii atomici.
Modelul atomic cuantic, dezvoltat de fizicieni precum Niels Bohr, Erwin Schrödinger și Werner Heisenberg, se bazează pe principiile mecanicii cuantice pentru a descrie comportamentul electronilor în atomi. Această teorie a revoluționat înțelegerea structurii atomice, oferind o explicație mai precisă a proprietăților atomilor și a spectrului lor de emisie.
În modelul atomic cuantic, electronii nu mai sunt considerați particule clasice care orbitează nucleul, ci mai degrabă ca unde staționare, descrise de funcții de undă. Aceste funcții de undă, soluții ale ecuației Schrödinger, descriu probabilitatea de a găsi un electron într-un anumit punct din spațiu. Fiecare funcție de undă este caracterizată de un set de numere cuantice, care descriu proprietățile electronului.
2.Numerele Cuantice
Numerele cuantice sunt un set de numere care descriu proprietățile electronilor din atomi, inclusiv energia, forma și orientarea spațială a orbitalilor atomici. Există patru tipuri principale de numere cuantice⁚
- Numărul cuantic principal (n)⁚ descrie nivelul de energie al electronului. Poate lua valori întregi pozitive, cum ar fi 1, 2, 3, etc., cu valori mai mari corespunzând nivelurilor de energie mai înalte; De exemplu, n=1 corespunde stării electronice fundamentale, n=2 corespunde primului nivel excitat, și așa mai departe.
- Numărul cuantic azimutal sau numărul cuantic al momentului unghiular (l)⁚ descrie forma orbitalului atomic și are valori cuprinse între 0 și n-l=0 corespunde unui orbital s, care este sferic, l=1 corespunde unui orbital p, care are forma de halteră, l=2 corespunde unui orbital d, care are o formă mai complexă, și așa mai departe.
- Numărul cuantic magnetic (ml)⁚ descrie orientarea spațială a orbitalului atomic. Poate lua valori întregi de la -l la +l, inclusiv 0. De exemplu, pentru l=1, ml poate lua valorile -1, 0, +1, corespunzând celor trei orbitali p orientate de-a lungul axelor x, y, și z.
- Numărul cuantic de spin (ms)⁚ descrie momentul unghiular intrinsec al electronului, cunoscut ca spin. Electronii au un spin intrinsec, care poate fi reprezentat ca o rotire pe o axă, iar spinul poate fi orientat în sus (ms=+1/2) sau în jos (ms=-1/2).
Numerele cuantice sunt interconectate și respectă anumite reguli. De exemplu, numărul cuantic principal (n) determină numărul de subnivele și de orbitali atomici posibili într-un atom. Numărul cuantic azimutal (l) determină forma orbitalului atomic, iar numărul cuantic magnetic (ml) determină orientarea spațială a orbitalului. Numerele cuantice sunt instrumente esențiale pentru înțelegerea structurii atomice și a comportamentului electronilor în atomi.
2.Orbitalii Atomici
Orbitalii atomici sunt regiuni din spațiu în care există o probabilitate mare de a găsi un electron. Fiecare orbital atomic este caracterizat de un set de numere cuantice, inclusiv numărul cuantic principal (n) și numărul cuantic azimutal (l). Forma orbitalului atomic este determinată de numărul cuantic azimutal (l).
- Orbitalii s (l=0)⁚ sunt sferici și au o singură orientare spațială. De exemplu, orbitalul 1s este cel mai mic orbital s, iar orbitalul 2s este mai mare, dar are aceeași formă sferică.
- Orbitalii p (l=1)⁚ au forma de halteră și au trei orientări spațiale, de-a lungul axelor x, y, și z. De exemplu, orbitalul 2p are trei orbitali p, 2px, 2py, și 2pz.
- Orbitalii d (l=2)⁚ au forme mai complexe și au cinci orientări spațiale. De exemplu, orbitalul 3d are cinci orbitali d, 3dxy, 3dxz, 3dyz, 3dx2-y2, și 3dz2.
- Orbitalii f (l=3)⁚ au forme și mai complexe și au șapte orientări spațiale. De exemplu, orbitalul 4f are șapte orbitali f.
Orbitalii atomici sunt importante pentru înțelegerea structurii electronice a atomilor și a legăturilor chimice. Numărul de orbitali atomici într-un atom este determinat de numărul cuantic principal (n), iar forma orbitalilor este determinată de numărul cuantic azimutal (l). Orbitalii atomici sunt elementele de bază ale modelului atomic cuantic și sunt esențiale pentru a explica proprietățile chimice ale elementelor.
Structura Atomică și Configurația Electronică
2.Numerele Cuantice
2.Orbitalii Atomici
2.Nivelurile de Energie și Subnivelele
Configurația Electronică a Atomilor
3.Principiul Aufbau
3.Regula lui Hund
3.Principiul Excluderii Pauli
Relația dintre Configurația Electronică și Proprietățile Chimice
Spectroscopia și Structura Electronică
Introducere în Subnivele
Tipuri de Subnivele
Proprietățile Subnivelurilor
Relația dintre Subnivele și Configurația Electronică
Exemple de Subnivele
Un subnivel este un set de orbitali atomici cu același număr cuantic principal (n) și același număr cuantic azimutal (l).
Introducere în Structura Atomică
Atomul este unitatea fundamentală a materiei, constând dintr-un nucleu central, format din protoni și neutroni, înconjurat de electroni. Structura atomică descrie aranjarea acestor particule subatomice și interacțiunile dintre ele. Înțelegerea structurii atomice este esențială pentru a explica proprietățile chimice ale elementelor și pentru a prezice comportamentul lor în reacțiile chimice.
Modelul atomic cuantic, dezvoltat în secolul XX, oferă o descriere mai precisă a structurii atomice, utilizând concepte precum numerele cuantice, orbitalii atomici și nivelurile de energie. Numerele cuantice descriu proprietățile electronilor din atomi, cum ar fi energia și momentul unghiular. Orbitalii atomici sunt regiuni din spațiu în care există o probabilitate mare de a găsi un electron, iar nivelurile de energie descriu stările energetice posibile ale electronilor.
Configurația electronică a unui atom descrie distribuția electronilor în orbitalii atomici, oferind o imagine a structurii electronice a atomului. Această configurație este determinată de principiul Aufbau, regula lui Hund și principiul excluderii Pauli, care descriu modul în care electronii ocupă orbitalii atomici.
Modelul Atomic Cuantic
Modelul atomic cuantic, dezvoltat de fizicieni precum Niels Bohr, Erwin Schrödinger și Werner Heisenberg, se bazează pe principiile mecanicii cuantice pentru a descrie comportamentul electronilor în atomi. Această teorie a revoluționat înțelegerea structurii atomice, oferind o explicație mai precisă a proprietăților atomilor și a spectrului lor de emisie.
În modelul atomic cuantic, electronii nu mai sunt considerați particule clasice care orbitează nucleul, ci mai degrabă ca unde staționare, descrise de funcții de undă. Aceste funcții de undă, soluții ale ecuației Schrödinger, descriu probabilitatea de a găsi un electron într-un anumit punct din spațiu. Fiecare funcție de undă este caracterizată de un set de numere cuantice, care descriu proprietățile electronului.
2.Numerele Cuantice
Numerele cuantice sunt un set de numere care descriu proprietățile electronilor din atomi, inclusiv energia, forma și orientarea spațială a orbitalilor atomici. Există patru tipuri principale de numere cuantice⁚
- Numărul cuantic principal (n)⁚ descrie nivelul de energie al electronului. Poate lua valori întregi pozitive, cum ar fi 1, 2, 3, etc., cu valori mai mari corespunzând nivelurilor de energie mai înalte. De exemplu, n=1 corespunde stării electronice fundamentale, n=2 corespunde primului nivel excitat, și așa mai departe.
- Numărul cuantic azimutal sau numărul cuantic al momentului unghiular (l)⁚ descrie forma orbitalului atomic și are valori cuprinse între 0 și n-l=0 corespunde unui orbital s, care este sferic, l=1 corespunde unui orbital p, care are forma de halteră, l=2 corespunde unui orbital d, care are o formă mai complexă, și așa mai departe.
- Numărul cuantic magnetic (ml)⁚ descrie orientarea spațială a orbitalului atomic. Poate lua valori întregi de la -l la +l, inclusiv 0. De exemplu, pentru l=1, ml poate lua valorile -1, 0, +1, corespunzând celor trei orbitali p orientate de-a lungul axelor x, y, și z;
- Numărul cuantic de spin (ms)⁚ descrie momentul unghiular intrinsec al electronului, cunoscut ca spin. Electronii au un spin intrinsec, care poate fi reprezentat ca o rotire pe o axă, iar spinul poate fi orientat în sus (ms=+1/2) sau în jos (ms=-1/2).
Numerele cuantice sunt interconectate și respectă anumite reguli. De exemplu, numărul cuantic principal (n) determină numărul de subnivele și de orbitali atomici posibili într-un atom. Numărul cuantic azimutal (l) determină forma orbitalului atomic, iar numărul cuantic magnetic (ml) determină orientarea spațială a orbitalului. Numerele cuantice sunt instrumente esențiale pentru înțelegerea structurii atomice și a comportamentului electronilor în atomi.
2.Orbitalii Atomici
Orbitalii atomici sunt regiuni din spațiu în care există o probabilitate mare de a găsi un electron. Fiecare orbital atomic este caracterizat de un set de numere cuantice, inclusiv numărul cuantic principal (n) și numărul cuantic azimutal (l). Forma orbitalului atomic este determinată de numărul cuantic azimutal (l).
- Orbitalii s (l=0)⁚ sunt sferici și au o singură orientare spațială. De exemplu, orbitalul 1s este cel mai mic orbital s, iar orbitalul 2s este mai mare, dar are aceeași formă sferică.
- Orbitalii p (l=1)⁚ au forma de halteră și au trei orientări spațiale, de-a lungul axelor x, y, și z. De exemplu, orbitalul 2p are trei orbitali p, 2px, 2py, și 2pz.
- Orbitalii d (l=2)⁚ au forme mai complexe și au cinci orientări spațiale. De exemplu, orbitalul 3d are cinci orbitali d, 3dxy, 3dxz, 3dyz, 3dx2-y2, și 3dz2.
- Orbitalii f (l=3)⁚ au forme și mai complexe și au șapte orientări spațiale. De exemplu, orbitalul 4f are șapte orbitali f.
Orbitalii atomici sunt importante pentru înțelegerea structurii electronice a atomilor și a legăturilor chimice. Numărul de orbitali atomici într-un atom este determinat de numărul cuantic principal (n), iar forma orbitalilor este determinată de numărul cuantic azimutal (l). Orbitalii atomici sunt elementele de bază ale modelului atomic cuantic și sunt esențiale pentru a explica proprietățile chimice ale elementelor.
2.Nivelurile de Energie și Subnivelele
Electronii dintr-un atom ocupă niveluri de energie diferite, iar aceste niveluri de energie sunt cuantificate, adică pot lua doar valori discrete. Nivelurile de energie sunt reprezentate de numărul cuantic principal (n), cu valori mai mari corespunzând nivelurilor de energie mai înalte. De exemplu, n=1 corespunde nivelului de energie fundamental, n=2 corespunde primului nivel excitat, și așa mai departe.
Fiecare nivel de energie este împărțit în subnivele, care sunt grupuri de orbitali atomici cu același număr cuantic principal (n) și același număr cuantic azimutal (l). De exemplu, nivelul de energie n=2 are două subnivele⁚ subnivelul 2s (l=0) și subnivelul 2p (l=1). Subnivelul 2s are un singur orbital s, iar subnivelul 2p are trei orbitali p.
Subnivelele sunt ordonate în funcție de energia lor, cu subnivelele s având cea mai mică energie, urmate de subnivelele p, d, și f. Această ordine este importantă pentru a determina configurația electronică a atomilor.
Nivelurile de energie și subnivelele sunt concepte esențiale pentru a explica proprietățile chimice ale elementelor, cum ar fi reactivitatea, conductivitatea electrică și proprietățile optice. Înțelegerea structurii electronice a atomilor, inclusiv a nivelurilor de energie și a subnivelurilor, este esențială pentru a prezice comportamentul elementelor în reacțiile chimice.
Articolul prezintă o introducere clară și concisă în structura atomică, punând accentul pe modelul atomic cuantic și pe importanța sa în explicarea proprietăților chimice. Explicația numerelor cuantice, a orbitalilor atomici și a nivelurilor de energie este bine structurată și ușor de înțeles. Prezentarea principiului Aufbau, a regulii lui Hund și a principiului excluderii Pauli este utilă pentru înțelegerea configurației electronice a atomilor.
Articolul este bine scris și prezintă o introducere cuprinzătoare în structura atomică, punând accentul pe modelul atomic cuantic. Explicația numerelor cuantice, a orbitalilor atomici și a nivelurilor de energie este clară și bine structurată. Aș recomanda adăugarea unor secțiuni suplimentare care să aprofundeze aspecte specifice, cum ar fi legăturile chimice sau spectroscopia atomică.
Articolul abordează un subiect complex într-un mod accesibil, oferind o introducere solidă în structura atomică și în modelul atomic cuantic. Prezentarea numerelor cuantice, a orbitalilor atomici și a nivelurilor de energie este clară și bine ilustrată. Aș recomanda adăugarea unor exemple concrete pentru a ilustra mai bine aplicarea principiului Aufbau, a regulii lui Hund și a principiului excluderii Pauli.
Articolul este o introducere excelentă în structura atomică, oferind o explicație clară și concisă a modelului atomic cuantic. Prezentarea numerelor cuantice, a orbitalilor atomici și a nivelurilor de energie este bine structurată și ușor de înțeles. Aș sugera adăugarea unor exerciții sau probleme practice pentru a consolida înțelegerea conceptelor prezentate.
Articolul este bine scris și prezintă o introducere cuprinzătoare în structura atomică, acoperind aspecte importante precum modelul atomic cuantic, numerele cuantice, orbitalii atomici și nivelurile de energie. Explicația principiului Aufbau, a regulii lui Hund și a principiului excluderii Pauli este concisă și ușor de înțeles. Aș recomanda adăugarea unor diagrame sau imagini pentru a vizualiza mai bine conceptele prezentate.
Articolul prezintă o introducere cuprinzătoare în structura atomică, acoperind aspecte importante precum modelul atomic cuantic, numerele cuantice, orbitalii atomici și nivelurile de energie. Explicația principiului Aufbau, a regulii lui Hund și a principiului excluderii Pauli este clară și bine ilustrată. Aș recomanda adăugarea unor referințe bibliografice pentru a aprofunda subiectul.
Articolul oferă o introducere excelentă în structura atomică, punând accentul pe modelul atomic cuantic. Prezentarea numerelor cuantice, a orbitalilor atomici și a nivelurilor de energie este clară și bine structurată. Aș recomanda adăugarea unor secțiuni suplimentare care să aprofundeze aspecte specifice, cum ar fi legăturile chimice sau spectroscopia atomică.
Articolul oferă o introducere excelentă în structura atomică, punând accentul pe modelul atomic cuantic. Prezentarea numerelor cuantice, a orbitalilor atomici și a nivelurilor de energie este clară și bine structurată. Aș sugera adăugarea unor exemple practice pentru a ilustra mai bine aplicarea principiului Aufbau, a regulii lui Hund și a principiului excluderii Pauli.
Articolul oferă o introducere excelentă în structura atomică, acoperind aspecte importante precum modelul atomic cuantic, numerele cuantice, orbitalii atomici și nivelurile de energie. Explicația principiului Aufbau, a regulii lui Hund și a principiului excluderii Pauli este concisă și ușor de înțeles. Aș sugera adăugarea unor diagrame sau imagini pentru a vizualiza mai bine conceptele prezentate.