Tabelul periodic al elementelor
Introducere
Tabelul periodic al elementelor este o reprezentare sistematică a tuturor elementelor chimice cunoscute, ordonate în funcție de numărul lor atomic crescător și de proprietățile lor chimice recurente.
Tabelul periodic este un instrument esențial în chimie, oferind o imagine de ansamblu a elementelor, a proprietăților lor și a relațiilor dintre ele.
1. Definiția tabelului periodic
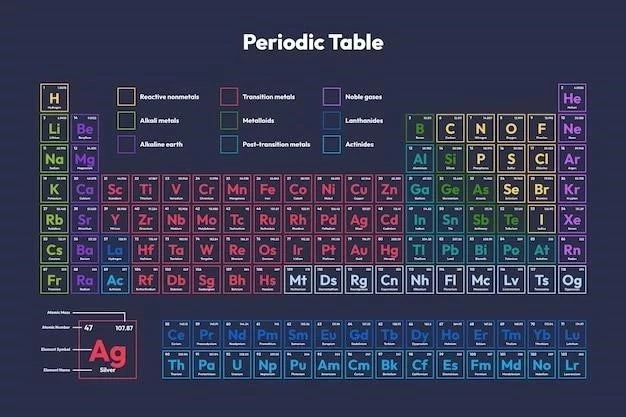
Tabelul periodic al elementelor, cunoscut și sub numele de tabelul lui Mendeleev, este o reprezentare grafică a tuturor elementelor chimice cunoscute, organizate în funcție de numărul lor atomic crescător și de proprietățile lor chimice recurente. Această organizare sistematică permite o înțelegere profundă a relațiilor dintre elemente și a modului în care proprietățile lor variază periodic. Fiecare element este reprezentat printr-un simbol chimic unic, care este o abreviere a numelui său.
Tabelul periodic este împărțit în perioade și grupe. Perioadele sunt rândurile orizontale ale tabelului, iar grupele sunt coloanele verticale. Elementele din aceeași perioadă au același număr de straturi electronice, în timp ce elementele din aceeași grupă au același număr de electroni de valență.
În tabelul periodic, elementele sunt aranjate astfel încât elementele cu proprietăți chimice similare să fie grupate împreună. Această organizare reflectă legea periodică, care afirmă că proprietățile chimice ale elementelor sunt funcții periodice ale numărului lor atomic.
2. Importanța tabelului periodic
Tabelul periodic este un instrument esențial în chimie, oferind o imagine de ansamblu a elementelor, a proprietăților lor și a relațiilor dintre ele. Importanța sa se reflectă în numeroasele sale aplicații în diverse domenii științifice și tehnologice.
Tabelul periodic este un instrument de predicție, permițând chimiștilor să prezică proprietățile elementelor necunoscute sau să extrapoleze proprietățile elementelor cunoscute. De asemenea, el facilitează înțelegerea reacțiilor chimice, a legăturilor chimice și a structurii moleculelor.
În plus, tabelul periodic este un instrument de organizare a informațiilor chimice, facilitând accesul rapid și eficient la datele despre elemente. Este un instrument de învățare, oferind o bază solidă pentru înțelegerea chimiei, a proprietăților elementelor și a relațiilor dintre ele.
Elementele chimice
Elementele chimice sunt substanțe pure care nu pot fi descompuse în substanțe mai simple prin metode chimice.
1. Atomi și izotopi
Unitatea fundamentală a unui element chimic este atomul, o particulă microscopică care conține un nucleu central format din protoni și neutroni, înconjurat de un nor de electroni. Numărul de protoni din nucleul unui atom, numit număr atomic (Z), definește identitatea elementului. De exemplu, toți atomii de hidrogen au un singur proton (Z = 1), în timp ce toți atomii de oxigen au opt protoni (Z = 8).
Izotopii sunt atomi ai aceluiași element care au același număr de protoni, dar un număr diferit de neutroni. Aceasta înseamnă că izotopii unui element au același număr atomic, dar mase atomice diferite. De exemplu, carbonul are doi izotopi stabili⁚ carbon-12 ($^{12}$C) cu șase protoni și șase neutroni și carbon-13 ($^{13}$C) cu șase protoni și șapte neutroni.
Masa atomică a unui element este o medie ponderată a maselor atomice ale tuturor izotopilor săi naturali, luând în considerare abundența lor relativă. Aceasta înseamnă că masa atomică a unui element nu este un număr întreg, ci un număr zecimal. De exemplu, masa atomică a carbonului este 12,011 u.a.m., ceea ce reflectă abundența relativă a izotopilor săi naturali.
2. Masa atomică și masa molară
Masa atomică a unui element este o măsură a masei sale relative, exprimată în unități de masă atomică (u.a.m.). O unitate de masă atomică este definită ca 1/12 din masa unui atom de carbon-12. Masa atomică a unui element este prezentată în tabelul periodic, de obicei sub simbolul chimic al elementului.
Masa molară a unui element este masa unui mol de atomi ai acelui element, exprimată în grame pe mol (g/mol). Un mol este o unitate de cantitate de substanță care conține 6,022 x 1023 entități elementare (atomi, molecule, ioni etc.). Masa molară a unui element este numeric egală cu masa atomică a elementului, dar exprimată în grame pe mol.
De exemplu, masa atomică a carbonului este 12,011 u.a.m., iar masa molară a carbonului este 12,011 g/mol. Aceasta înseamnă că un mol de atomi de carbon are o masă de 12,011 grame.
3; Numărul atomic și simbolul chimic
Numărul atomic al unui element este egal cu numărul de protoni din nucleul atomului său. Numărul atomic este un număr întreg unic pentru fiecare element și este reprezentat de simbolul Z. De exemplu, numărul atomic al hidrogenului este 1, ceea ce înseamnă că un atom de hidrogen are un singur proton în nucleul său.
Simbolul chimic al unui element este o abreviere de una sau două litere care reprezintă elementul. Prima literă a simbolului chimic este întotdeauna scrisă cu majusculă, iar a doua literă, dacă există, este scrisă cu minusculă. De exemplu, simbolul chimic al hidrogenului este H, iar simbolul chimic al oxigenului este O.
Numărul atomic și simbolul chimic sunt utilizate pentru a identifica în mod unic fiecare element din tabelul periodic. Aceste informații sunt esențiale pentru înțelegerea proprietăților chimice ale elementelor și pentru a prezice cum vor reacționa ele cu alte elemente.
Legea periodică
Legea periodică afirmă că proprietățile chimice ale elementelor sunt o funcție periodică a numerelor lor atomice.
Tabelul periodic prezintă tendințe regulate în proprietățile chimice ale elementelor, cum ar fi electronegativitatea, energia de ionizare și raza atomică.
1. Proprietățile chimice ale elementelor
Proprietățile chimice ale elementelor sunt determinate de configurația electronică a atomilor lor, care la rândul ei este influențată de numărul atomic. Legea periodică se bazează pe observația că proprietățile chimice ale elementelor se repetă periodic în funcție de numărul atomic. Această periodicitate se datorează faptului că atomii elementelor din aceeași grupă au același număr de electroni de valență, adică electroni din ultimul strat electronic.
De exemplu, elementele din grupa 1 (metalele alcaline) au toate un singur electron de valență, ceea ce le conferă o reactivitate chimică ridicată. Elementele din grupa 17 (halogenii) au șapte electroni de valență și tind să formeze anioni cu o sarcină de -1.
Proprietățile chimice ale elementelor sunt influențate de mai mulți factori, inclusiv⁚
- Electronegativitatea⁚ Măsura atracției unui atom pentru electronii din legătura chimică.
- Energia de ionizare⁚ Energia necesară pentru a elimina un electron dintr-un atom.
- Raza atomică⁚ Distanța medie dintre nucleul atomului și electronul său cel mai îndepărtat.
- Afinitatea electronică⁚ Energia eliberată atunci când un atom câștigă un electron.
Aceste proprietăți sunt legate între ele și influențează modul în care elementele reacționează cu alte elemente.
2. Tendințele în tabelul periodic
Tabelul periodic prezintă o serie de tendințe sistematice în proprietățile chimice ale elementelor, reflectând variația configurației electronice a atomilor. Aceste tendințe permit prezicerea comportamentului chimic al elementelor și înțelegerea relațiilor dintre ele.
Una dintre cele mai importante tendințe este variația electronegativității. Electronegativitatea crește de la stânga la dreapta într-o perioadă și de jos în sus într-o grupă. Aceasta înseamnă că elementele din colțul dreapta-sus al tabelului periodic au cea mai mare electronegativitate, în timp ce elementele din colțul stânga-jos au cea mai mică electronegativitate.
O altă tendință importantă este variația energiei de ionizare. Energia de ionizare crește de la stânga la dreapta într-o perioadă și de jos în sus într-o grupă. Aceasta se datorează faptului că electronii din ultimul strat electronic sunt mai puternic atrași de nucleu în elementele din dreapta tabelului periodic.
Raza atomică scade de la stânga la dreapta într-o perioadă și crește de jos în sus într-o grupă. Această tendință este legată de atracția nucleului pentru electroni.
Afinitatea electronică crește de la stânga la dreapta într-o perioadă și scade de jos în sus într-o grupă.
Înțelegerea acestor tendințe este esențială pentru a prezice comportamentul chimic al elementelor și pentru a interpreta reacțiile chimice.
Structura tabelului periodic
Tabelul periodic este organizat în șapte perioade, reprezentând nivelele de energie ale electronilor, și 18 grupe, reprezentând numărul de electroni de valență.
Elementele din tabelul periodic sunt clasificate în metale, nemetale și metaloizi, în funcție de proprietățile lor chimice și fizice.
1. Perioadele și grupele
Tabelul periodic este organizat într-o structură sistematică, care reflectă proprietățile chimice recurente ale elementelor. Această structură se bazează pe două categorii principale⁚ perioadele și grupele.
Perioadele sunt rândurile orizontale ale tabelului periodic, numerotate de la 1 la 7. Fiecare perioadă reprezintă un nivel de energie electronică distinct. Elementele din aceeași perioadă au același număr de straturi electronice, dar diferă în numărul de electroni de valență. De exemplu, elementele din perioada a doua (Li, Be, B, C, N, O, F, Ne) au toate două straturi electronice, dar numărul de electroni de valență variază de la 1 la 8.
Grupele sunt coloanele verticale ale tabelului periodic, numerotate de la 1 la 18. Elementele din aceeași grupă au același număr de electroni de valență, ceea ce le conferă proprietăți chimice similare. De exemplu, elementele din grupa 1 (Li, Na, K, Rb, Cs, Fr) sunt toate metale alcaline, caracterizate printr-un singur electron de valență.
Organizarea elementelor în perioade și grupe permite o înțelegere mai profundă a relațiilor dintre elemente și a modului în care proprietățile lor chimice variază în funcție de poziția lor în tabelul periodic.
2. Metale, nemetale și metaloizi
Elementele chimice pot fi clasificate în trei categorii principale, în funcție de proprietățile lor fizice și chimice⁚ metale, nemetale și metaloizi. Această clasificare este reflectată în structura tabelului periodic, unde metalele ocupă majoritatea spațiului, nemetalele sunt grupate în partea dreaptă a tabelului, iar metaloizii formează o linie de separare între cele două.
Metalele sunt caracterizate printr-o serie de proprietăți specifice, cum ar fi conductivitatea electrică și termică ridicată, luciul metalic, maleabilitatea și ductilitatea. Ele tind să formeze ioni pozitivi (cationi) în reacții chimice. Exemple de metale includ fierul (Fe), cuprul (Cu), aurul (Au) și argintul (Ag).
Nemetalele, dimpotrivă, sunt caracterizate prin proprietăți opuse metalelor. Ele sunt în general izolatori electrici și termici, au o strălucire slabă sau deloc, sunt fragile și nu sunt maleabile sau ductile. Ele tind să formeze ioni negativi (anioni) în reacții chimice. Exemple de nemetale includ oxigenul (O), azotul (N), clorul (Cl) și bromul (Br).
Metaloizii, cunoscuți și sub numele de semimetale, prezintă proprietăți intermediare între metale și nemetale. Ele pot conduce electricitatea și căldura, dar nu la fel de bine ca metalele. Exemple de metaloizi includ siliciul (Si), germaniu (Ge) și arsenicul (As).
Aplicații ale tabelului periodic
Tabelul periodic are o gamă largă de aplicații în diverse domenii, de la chimie și inginerie chimică la educație și cercetare științifică.
1. Chimie
Tabelul periodic este un instrument esențial în chimie, oferind o bază fundamentală pentru înțelegerea și prezicerea comportamentului elementelor chimice. Cunoașterea maselor atomice acceptate pentru fiecare element permite chimiștilor să efectueze calcule precise în diverse reacții chimice. De exemplu, masa atomică a unui element este crucială pentru determinarea masei moleculare a unei substanțe, care este esențială pentru calcularea cantităților de reactanți și produse într-o reacție chimică.
În plus, tabelul periodic permite chimiștilor să prezică proprietățile chimice ale elementelor, cum ar fi reactivitatea, electronegativitatea și starea de oxidare, pe baza poziției lor în tabel. Această informație este crucială pentru proiectarea și sinteza noilor compuși chimici, precum și pentru înțelegerea reacțiilor chimice existente.
Tabelul periodic este, de asemenea, un instrument util pentru identificarea și clasificarea elementelor chimice, oferind o schemă sistematică pentru organizarea cunoștințelor chimice.
2. Inginerie chimică
În ingineria chimică, tabelul periodic joacă un rol crucial în proiectarea și optimizarea proceselor industriale. Cunoașterea maselor atomice acceptate este esențială pentru calcularea maselor moleculare, a densității, a viscozității și a altor proprietăți fizice ale substanțelor chimice utilizate în diverse procese.
De exemplu, inginerii chimici se bazează pe tabelul periodic pentru a calcula stoichiometria reacțiilor chimice, pentru a determina randamentele reacțiilor și pentru a optimiza condițiile de operare ale proceselor industriale. Cunoașterea proprietăților chimice ale elementelor, precum și a maselor lor atomice, este esențială pentru proiectarea reactoarelor chimice, a coloanelor de distilare și a altor echipamente utilizate în industria chimică.
Tabelul periodic este, de asemenea, un instrument util pentru selectarea materialelor potrivite pentru construcția echipamentelor chimice, având în vedere rezistența la coroziune, stabilitatea termică și alte proprietăți fizice ale elementelor.
3. Industria chimică
Industria chimică se bazează în mod esențial pe tabelul periodic pentru a produce o gamă largă de produse, de la materiale plastice și îngrășăminte până la medicamente și produse cosmetice. Cunoașterea maselor atomice acceptate este crucială pentru controlul calității, optimizarea proceselor de fabricație și dezvoltarea de noi produse.
De exemplu, în producția de îngrășăminte, tabelul periodic este utilizat pentru a determina proporțiile corecte de elemente nutritive, precum azotul, fosforul și potasiul, necesare pentru creșterea plantelor. În industria farmaceutică, tabelul periodic este esențial pentru sinteza și formularea medicamentelor, asigurând o dozare precisă a ingredientelor active.
În plus, tabelul periodic este un instrument important pentru dezvoltarea de noi materiale, precum polimeri, compozite și nanomateriale, cu proprietăți specifice necesare în diverse aplicații industriale.
4. Educație
Tabelul periodic este un instrument indispensabil în educația chimică, oferind un cadru fundamental pentru înțelegerea chimiei. Introducerea elevilor în tabelul periodic, inclusiv în conceptul de mase atomice acceptate, le permite să dezvolte o bază solidă pentru studiul chimiei.
Prin intermediul tabelului periodic, elevii învață despre structura atomilor, proprietățile elementelor, relațiile dintre ele și modul în care acestea se combină pentru a forma compuși. De asemenea, înțeleg conceptul de periodicitate, care explică tendințele recurente în proprietățile elementelor, cum ar fi electronegativitatea, energia de ionizare și raza atomică.
Utilizarea tabelului periodic în educație facilitează o învățare interactivă și stimulatoare, ajutând elevii să vizualizeze și să înțeleagă conceptele chimice complexe.
5. Cercetare
Tabelul periodic este un instrument esențial în cercetarea științifică, oferind un cadru fundamental pentru înțelegerea comportamentului elementelor și a relațiilor dintre ele. Cercetătorii din diverse domenii, cum ar fi chimia, fizica, biologia și geologia, se bazează pe tabelul periodic pentru a interpreta datele experimentale, a dezvolta noi materiale și a prezice proprietățile unor substanțe necunoscute.
De exemplu, chimiștii folosesc tabelul periodic pentru a prezice reacțiile chimice, a sintetiza noi compuși și a studia proprietățile materialelor. Fizicienii îl folosesc pentru a investiga structura atomilor, a studia proprietățile nucleare și a dezvolta noi tehnologii. Biologii îl folosesc pentru a înțelege rolul elementelor în organismele vii și a dezvolta noi medicamente.
Cercetarea continuă în domeniul chimiei duce la descoperirea de noi elemente și la rafinarea maselor atomice acceptate, contribuind la o mai bună înțelegere a lumii din jurul nostru.
Concluzie
1. Importanța tabelului periodic în știință
Tabelul periodic este un instrument esențial în știință, oferind o bază fundamentală pentru înțelegerea lumii din jurul nostru.
2. Viitorul tabelului periodic
Tabelul periodic este un instrument în continuă evoluție, reflectând progresele în cercetarea științifică.
Articolul este bine structurat și clar, oferind o introducere concisă și o explicație detaliată a tabelului periodic. Ar fi util să se includă o secțiune dedicată clasificării elementelor în funcție de proprietățile lor chimice.
Articolul este bine scris și informativ, dar ar putea fi îmbunătățit prin adăugarea unor exemple concrete de aplicații ale tabelului periodic în diverse domenii. De asemenea, ar fi utilă o discuție mai aprofundată a legii periodice și a implicațiilor sale.
Articolul oferă o prezentare generală excelentă a tabelului periodic, acoperind aspectele cheie ale conceptului. Utilizarea imaginilor și a diagramelor ar îmbunătăți vizualizarea și înțelegerea informațiilor prezentate.
Articolul este bine scris și informativ, oferind o prezentare generală excelentă a tabelului periodic. Ar fi util să se adauge o secțiune dedicată tendințelor periodice, cum ar fi variația electronegativității, energiei de ionizare și afinității electronice.
Articolul este bine scris și ușor de citit, oferind o prezentare generală completă a tabelului periodic. Explicațiile sunt clare și concise, iar exemplele utilizate sunt relevante. De asemenea, aprecierea importanței tabelului periodic în diverse domenii este bine argumentată.
Articolul prezintă o introducere clară și concisă a tabelului periodic, definind conceptul și evidențiind importanța sa în chimie. Explicația organizării tabelului periodic, inclusiv perioadele și grupele, este bine structurată și ușor de înțeles. De asemenea, se subliniază legea periodică și aplicațiile tabelului periodic în diverse domenii.
Articolul este bine documentat și prezintă informații relevante și precise. Structura este logică și ușor de urmărit. Ar fi util să se includă și o secțiune dedicată istoriei tabelului periodic, menționând contribuțiile unor savanți importanți.