Tabelul periodic al elementelor
Introducere
Tabelul periodic al elementelor este un instrument esențial în chimie, oferind o organizare sistematică a elementelor chimice, reflectând proprietățile lor și relațiile dintre ele.
Tabelul periodic este utilizat pe scară largă în chimie, de la prezicerea proprietăților elementelor la înțelegerea reacțiilor chimice și a legăturilor chimice.
Importanța tabelului periodic
Tabelul periodic al elementelor este un instrument esențial în chimie, oferind o organizare sistematică a elementelor chimice, reflectând proprietățile lor și relațiile dintre ele. El este o hartă a universului chimic, care ne permite să înțelegem comportamentul elementelor și să prezicem reacțiile chimice. Importanța sa se reflectă în capacitatea de a⁚
- Organiza și clasifica elementele chimice în funcție de proprietățile lor.
- Prezenta o imagine de ansamblu a relațiilor dintre elemente.
- Prezicerea proprietăților elementelor necunoscute.
- Înțelegerea reacțiilor chimice și a legăturilor chimice.
Înțelegerea tabelului periodic este esențială pentru studierea chimiei, având aplicații vaste în diverse domenii, de la medicină la inginerie.
Utilizarea tabelului periodic în chimie
Tabelul periodic este un instrument indispensabil în chimie, oferind o bază solidă pentru înțelegerea și prezicerea comportamentului elementelor. Utilizarea sa este vastă și cuprinde⁚
- Predicția proprietăților elementelor⁚ Tabelul periodic ne permite să prezicem proprietățile chimice ale elementelor, cum ar fi reactivitatea, electronegativitatea și energia de ionizare, pe baza poziției lor în tabel.
- Înțelegerea reacțiilor chimice⁚ Tabelul periodic ne ajută să înțelegem de ce anumite elemente reacționează între ele, iar altele nu, și ne permite să prezicem produsele reacțiilor chimice.
- Determinarea structurii atomilor⁚ Tabelul periodic ne oferă informații despre numărul de protoni, neutroni și electroni dintr-un atom, ceea ce ne permite să înțelegem structura sa electronică.
- Dezvoltarea de noi materiale⁚ Tabelul periodic este un instrument esențial în dezvoltarea de noi materiale cu proprietăți specifice, cum ar fi conductivitatea electrică sau rezistența la căldură.
Utilizarea tabelului periodic este esențială în toate domeniile chimiei, de la chimia organică la chimia anorganică.
Elementele chimice
Elementele chimice sunt substanțe pure care nu pot fi descompuse în substanțe mai simple prin metode chimice obișnuite.
Numărul atomic, notat cu $Z$, reprezintă numărul de protoni din nucleul unui atom, definind identitatea elementului.
Masa atomică, notată cu $A$, reprezintă masa medie a atomilor unui element, exprimată în unități de masă atomică (u.a.m.).
Atomii⁚ blocurile de construcție ale materiei
Atomii sunt unitățile fundamentale ale materiei, constituind cele mai mici particule dintr-un element care păstrează proprietățile chimice ale acelui element. Un atom este compus dintr-un nucleu central, format din protoni și neutroni, înconjurat de un nor de electroni. Protoni, particule cu sarcină electrică pozitivă, determină identitatea elementului, iar neutronii, particule neutre din punct de vedere electric, contribuie la masa atomului. Electronii, particule cu sarcină electrică negativă, se mișcă în jurul nucleului, formând un nor electronic, și sunt responsabili de interacțiunile chimice ale atomului.
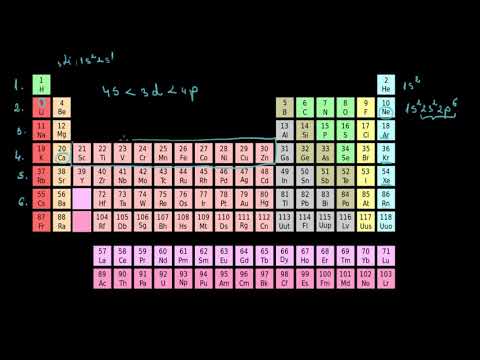
Numărul atomic⁚ Identificarea elementelor
Numărul atomic, notat cu simbolul Z, reprezintă numărul de protoni din nucleul unui atom. Fiecare element chimic are un număr atomic unic, care îl identifică și îl diferențiază de celelalte elemente. De exemplu, hidrogenul (H) are numărul atomic 1, heliu (He) are numărul atomic 2, iar oxigenul (O) are numărul atomic 8. Numărul atomic este un concept fundamental în chimie, deoarece determină proprietățile chimice ale unui element și poziția sa în tabelul periodic.
Masa atomică⁚ Greutatea atomilor
Masa atomică, notată cu simbolul A, reprezintă masa medie a atomilor unui element, exprimată în unități de masă atomică (u.a.m.). Masa atomică ia în considerare abundența izotopilor unui element, adică a atomilor cu același număr atomic, dar cu număr diferit de neutroni în nucleu. De exemplu, masa atomică a carbonului (C) este 12.011 u.a.m., deoarece există izotopi ai carbonului cu mase atomice diferite, cum ar fi carbon-12 (12C) și carbon-13 (13C). Masa atomică este un parametru important în chimie, deoarece influențează reacțiile chimice și proprietățile fizice ale elementelor.
Organizarea tabelului periodic
Tabelul periodic este organizat în funcție de numărul atomic al elementelor, reflectând periodicitatea proprietăților chimice.
Grupe⁚ Coloane verticale
Grupele, reprezentate de coloanele verticale ale tabelului periodic, conțin elemente cu configurații electronice similare în stratul de valență. Această similaritate conduce la proprietăți chimice comune. De exemplu, elementele din grupa 1, cunoscute ca metale alcaline, au un singur electron de valență, ceea ce le conferă o reactivitate ridicată. Elementele din grupa 17, halogenii, au șapte electroni de valență și prezintă o afinitate puternică pentru electroni, formând cu ușurință anioni.
Perioade⁚ Rânduri orizontale
Perioadele, reprezentate de rândurile orizontale ale tabelului periodic, conțin elemente cu același număr de straturi electronice. Numărul perioadei corespunde numărului de straturi electronice ale atomilor elementelor din acea perioadă. De exemplu, elementele din perioada 2 au doi straturi electronice, iar cele din perioada 3 au trei straturi electronice. Pe măsură ce traversăm o perioadă de la stânga la dreapta, numărul de protoni din nucleu crește, ceea ce duce la o creștere a atracției nucleare asupra electronilor de valență, rezultând o scădere a razei atomice și o creștere a energiei de ionizare.
Proprietățile chimice ale elementelor
Proprietățile chimice ale elementelor sunt determinate de configurația electronică a atomilor lor, influențând modul în care aceștia interacționează cu alte substanțe.
Reactivitatea⁚ Cât de ușor reacționează un element?
Reactivitatea unui element se referă la tendința sa de a participa la reacții chimice. Elementele cu o reactivitate ridicată tind să formeze cu ușurință legături chimice cu alte elemente, în timp ce elementele cu o reactivitate scăzută sunt mai puțin reactive. Reactivitatea este influențată de factori precum configurația electronică a atomilor, energia de ionizare și electronegativitatea.
Electronegativitatea⁚ Atragerea electronilor
Electronegativitatea este o măsură a tendinței unui atom dintr-o moleculă de a atrage electroni spre sine. Elementele cu electronegativitate ridicată au o tendință mai mare de a atrage electroni, în timp ce elementele cu electronegativitate scăzută au o tendință mai mică. Electronegativitatea crește de-a lungul unei perioade din tabelul periodic și scade în josul unui grup. Această tendință este legată de configurația electronică a atomilor și de distanța dintre nucleul atomic și electronii de valență.
Energia de ionizare⁚ Energia necesară pentru a elimina un electron
Energia de ionizare este energia minimă necesară pentru a elimina un electron dintr-un atom neutru aflat în starea sa fundamentală, formând un ion pozitiv. Această energie este o măsură a atracției dintre nucleul atomic și electronii de valență. Energia de ionizare crește de-a lungul unei perioade din tabelul periodic, deoarece sarcina nucleară crește, ceea ce face mai dificilă îndepărtarea unui electron. Pe de altă parte, energia de ionizare scade în josul unui grup, deoarece distanța dintre nucleul atomic și electronii de valență crește, reducând atracția dintre acestea.
Tendințe în tabelul periodic
Proprietățile chimice ale elementelor prezintă tendințe specifice în tabelul periodic, reflectând organizarea lor și structura electronică.
Tendințe ale proprietăților chimice
În tabelul periodic, anumite proprietăți chimice ale elementelor variază predictibil în funcție de poziția lor. De exemplu, raza atomică, care este distanța medie dintre nucleul atomului și electronul său cel mai exterior, tinde să scadă de-a lungul unei perioade (de la stânga la dreapta) și să crească în josul unei grupe (de sus în jos). Această tendință se datorează creșterii numărului de protoni din nucleu, care atrage mai puternic electronii, reducând raza atomică. De asemenea, energia de ionizare, care este energia necesară pentru a elimina un electron dintr-un atom, tinde să crească de-a lungul unei perioade și să scadă în josul unei grupe.
Exemple de tendințe
Un exemplu clar de tendință în tabelul periodic este variația electronegativității. Electronegativitatea este o măsură a capacității unui atom de a atrage electroni într-o legătură chimică. Elementele din partea dreaptă sus a tabelului periodic, cum ar fi fluorul (F), au o electronegativitate ridicată, ceea ce înseamnă că au o tendință puternică de a atrage electroni. În schimb, elementele din partea stângă jos a tabelului periodic, cum ar fi cesiul (Cs), au o electronegativitate scăzută. Această tendință este explicată de poziția electronilor de valență în atomi, care sunt mai ușor de atras de nucleul atomului atunci când se află mai aproape de acesta și când sunt mai puțini în număr.
Memorarea tabelului periodic
Memorarea simbolurilor și numelor elementelor este o etapă esențială în stăpânirea tabelului periodic.
Memorarea elementelor
Memorarea elementelor din tabelul periodic poate părea o sarcină descurajantă, dar cu o strategie adecvată, poate deveni mai ușoară. Există mai multe tehnici eficiente pentru memorarea elementelor, de la repetarea simplă la utilizarea mnemonicei. O metodă simplă este repetarea constantă a numelor și simbolurilor elementelor, fie prin scrierea lor, fie prin citirea lor cu voce tare. Această metodă necesită timp și consecvență, dar poate fi eficientă pentru cei care preferă o abordare mai tradițională. O altă opțiune este utilizarea fișelor, unde pe o parte se scrie simbolul elementului, iar pe cealaltă parte numele acestuia. Această tehnică permite o revizuire rapidă și eficientă a informațiilor.
Utilizarea mnemonicei
Mnemonicele sunt instrumente utile pentru memorarea unor informații complexe, inclusiv a elementelor din tabelul periodic. Acestea constau în fraze sau acronime care ajută la asocierea elementelor cu anumite cuvinte sau concepte. De exemplu, pentru a memora primele elemente din grupa 1, se poate utiliza fraza “Li-Na-K-Rb-Cs-Fr”, unde fiecare literă inițială corespunde cu un element. O altă mnemonică populară este “H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar”, care enumeră primele 18 elemente în ordinea lor din tabelul periodic. Mnemonicele pot fi create personalizate, adaptate la preferințele individuale, ceea ce le face mai eficiente și mai ușor de reținut.
Crearea de fișe
Fișele sunt o metodă clasică și eficientă de memorare a informațiilor. Pentru a crea fișe eficiente pentru tabelul periodic, se recomandă includerea pe o parte a numelui elementului, simbolului chimic, numărului atomic și a masei atomice, iar pe cealaltă parte, informații suplimentare, cum ar fi configurația electronică, electronegativitatea, energia de ionizare, proprietățile chimice și o scurtă descriere a utilizărilor elementului. Fișele pot fi create manual sau cu ajutorul unor aplicații dedicate. Este important să se utilizeze o varietate de culori, imagini și diagrame pentru a stimula memoria vizuală și a face procesul de învățare mai interactiv.
Strategii de învățare
Memorarea tabelului periodic necesită o abordare sistematică, cu accent pe practică regulată, utilizarea resurselor online și aplicarea tehnicilor de învățare activă.
Practică regulată
Practica regulată este esențială pentru memorarea tabelului periodic. Repetați numele elementelor, numerele atomice și simbolurile, folosind diverse metode. Creați fișe cu informații cheie și testați-vă periodic. Încercați să identificați elementele pe tabelul periodic fără a consulta o listă. Practicați scrierea formulelor chimice și a ecuațiilor chimice, incluzând simbolurile elementelor. Cu cât dedicați mai mult timp practicii, cu atât veți reține mai bine informațiile.
Utilizarea resurselor online
Resursele online oferă o gamă largă de instrumente și materiale pentru învățarea tabelului periodic. Există site-uri web interactive care permit explorarea tabelului periodic, vizualizarea proprietăților elementelor și testarea cunoștințelor. Aplicații mobile dedicate memorării tabelului periodic pot fi de asemenea utile. Videoclipurile explicative și animațiile online pot facilita înțelegerea conceptelor chimice asociate cu elementele. Utilizarea resurselor online poate face învățarea tabelului periodic mai interactivă și mai captivantă.
Întrebări și răspunsuri
O metodă eficientă de a consolida cunoștințele despre tabelul periodic este prin intermediul întrebărilor și răspunsurilor. Auto-testarea cu întrebări de tipul “Care este numărul atomic al oxigenului?” sau “În ce grup se află clorul?” poate ajuta la identificarea punctelor slabe și la consolidarea informațiilor. De asemenea, discutarea întrebărilor cu colegii de studiu poate facilita înțelegerea reciprocă și poate oferi perspective noi. Platformele online dedicate întrebărilor și răspunsurilor pot oferi o gamă largă de exerciții și teste pentru a consolida cunoștințele.
Concluzie
Înțelegerea tabelului periodic este esențială pentru o fundamentare solidă în chimie, deschizând calea către o explorare mai profundă a lumii atomilor și a reacțiilor chimice.
Importanța înțelegerii tabelului periodic
Înțelegerea tabelului periodic este esențială pentru o fundamentare solidă în chimie. Acesta oferă o hartă a elementelor chimice, organizate în funcție de proprietățile lor, permițând o înțelegere mai profundă a reacțiilor chimice și a legăturilor chimice. Cunoașterea tabelului periodic facilitează prezicerea comportamentului elementelor, ajutând la înțelegerea structurii materiei la nivel atomic. De asemenea, oferă o perspectivă asupra evoluției elementelor în natură, de la cele mai ușoare la cele mai grele. Prin urmare, o înțelegere profundă a tabelului periodic este crucială pentru orice student sau profesionist în domeniul chimiei.
Aplicații în știință și educație
Tabelul periodic are aplicații vaste atât în știință, cât și în educație. În știință, este utilizat în diverse domenii, de la chimie și fizică la biologie și geologie. De exemplu, chimiștii îl folosesc pentru a prezice reacțiile chimice și a sintetiza noi materiale, iar fizicienii îl folosesc pentru a studia structura atomilor și a nucleelor atomice. În educație, tabelul periodic joacă un rol crucial în predarea chimiei, oferind un cadru pentru înțelegerea proprietăților elementelor și a relațiilor dintre ele. De asemenea, este un instrument util pentru dezvoltarea gândirii logice și a abilităților de rezolvare a problemelor.
Articolul prezintă o introducere concisă și clară a importanței tabelului periodic în chimie. Explicațiile oferite sunt ușor de înțeles și utile pentru înțelegerea rolului esențial al tabelului periodic în diverse domenii ale chimiei.
Articolul prezintă o imagine de ansamblu clară și concisă a importanței tabelului periodic în chimie. Explicațiile sunt bine structurate și ușor de înțeles, făcând articolul o resursă utilă pentru cei care doresc să înțeleagă mai bine acest instrument esențial.
Articolul evidențiază importanța tabelului periodic în chimie, prezentând clar și succint rolul său în organizarea, clasificarea și prezicerea proprietăților elementelor chimice. Explicațiile oferite sunt clare și ușor de înțeles, făcând articolul accesibil unui public larg.
Articolul oferă o introducere solidă în importanța tabelului periodic în chimie. Explicațiile sunt clare și concise, iar exemplele oferite sunt utile pentru a ilustra diversele aplicații ale tabelului periodic.