Tabelul periodic al elementelor
Introducere
Ce este tabelul periodic?
Tabelul periodic al elementelor este un instrument esențial în chimie, care organizează toate elementele chimice cunoscute în funcție de proprietățile lor chimice și fizice․
Tabelul periodic este fundamental pentru înțelegerea chimiei, oferind o perspectivă asupra structurii atomilor, proprietăților elementelor și modului în care acestea interacționează․
Ce este tabelul periodic?
Tabelul periodic al elementelor este un instrument esențial în chimie, care organizează toate elementele chimice cunoscute în funcție de proprietățile lor chimice și fizice․ Acesta este o reprezentare grafică a elementelor chimice, aranjate în ordine crescătoare a numărului atomic, care reprezintă numărul de protoni din nucleul unui atom․ Elementele cu proprietăți chimice similare sunt grupate în coloane verticale, numite grupuri sau familii, iar liniile orizontale sunt numite perioade․
Fiecare element din tabelul periodic are o casetă care conține simbolul chimic, numărul atomic, masa atomică și alte informații relevante․ Simbolul chimic este o abreviere a numelui elementului, de obicei formată din una sau două litere․ Numărul atomic este un număr întreg care indică numărul de protoni din nucleul unui atom, iar masa atomică este o valoare medie a maselor atomice ale izotopilor unui element․
Importanța tabelului periodic în chimie
Tabelul periodic este un instrument fundamental pentru înțelegerea chimiei, oferind o perspectivă asupra structurii atomilor, proprietăților elementelor și modului în care acestea interacționează․ Acesta permite chimiștilor să prezică și să explice comportamentul elementelor, să înțeleagă legăturile chimice, să prezică reacțiile chimice și să determine proprietățile compușilor․
Cu ajutorul tabelului periodic, chimiștii pot determina numărul de electroni de valență ai unui element, care joacă un rol crucial în formarea legăturilor chimice․ De asemenea, tabelul periodic permite predicția tendințelor periodice, cum ar fi electronegativitatea, energia de ionizare și afinitatea electronică, care influențează reactivitatea elementelor․
Prin urmare, tabelul periodic este un instrument esențial pentru studiul chimiei, oferind o bază solidă pentru înțelegerea proprietăților elementelor și a modului în care acestea interacționează․
Structura tabelului periodic
Tabelul periodic este organizat într-o matrice cu 18 coloane, numite grupe, și 7 rânduri, numite perioade․
Grupe și perioade
Elementele din aceeași grupă (coloană) au același număr de electroni de valență, ceea ce le conferă proprietăți chimice similare․ De exemplu, elementele din grupa 1 (metalele alcaline) au un electron de valență, ceea ce le face foarte reactive․ Elementele din grupa 17 (halogenii) au șapte electroni de valență, ceea ce le face foarte electronegative․
Elementele din aceeași perioadă (rând) au același număr de nivele de energie electronice․ Pe măsură ce ne deplasăm de-a lungul unei perioade, numărul de protoni din nucleul atomului crește, iar electronii sunt adăugați la același nivel de energie․ Aceasta duce la o creștere a atracției nucleare și la o scădere a razei atomice․
Numărul perioadei corespunde cu numărul nivelurilor de energie electronice din atom․ De exemplu, elementele din perioada 2 au doi nivele de energie electronice, iar elementele din perioada 3 au trei nivele de energie electronice․
Numărul atomic și masa atomică
Numărul atomic (Z) al unui element reprezintă numărul de protoni din nucleul atomului său․ Numărul atomic este unic pentru fiecare element și este afișat în partea de sus a casetei elementului din tabelul periodic․ De exemplu, numărul atomic al hidrogenului este 1, ceea ce înseamnă că un atom de hidrogen are un singur proton․
Masa atomică (A) a unui element reprezintă masa medie a atomilor acelui element, exprimată în unități de masă atomică (u․a․m․)․ Masa atomică este o valoare medie, deoarece atomii unui element pot avea mase ușor diferite datorită prezenței izotopilor․ Masa atomică este afișată în partea de jos a casetei elementului din tabelul periodic․
Masa atomică este aproximativ egală cu suma numărului de protoni și neutroni din nucleul atomului․ De exemplu, masa atomică a carbonului este 12,011 u․a․m․, ceea ce înseamnă că un atom de carbon are în medie 6 protoni și 6 neutroni․
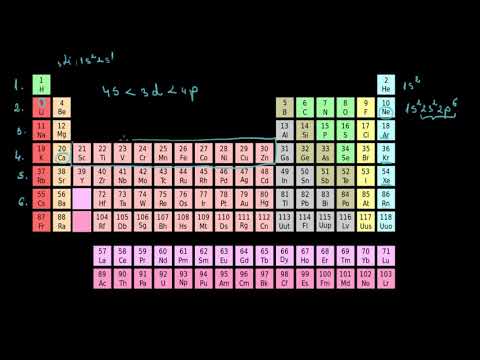
Configurația electronică
Configurația electronică a unui atom descrie modul în care electronii sunt aranjați în jurul nucleului․ Această configurație este importantă deoarece determină proprietățile chimice ale elementului․ Electronii sunt distribuiți în niveluri de energie, fiecare nivel fiind împărțit în subnivele․ Fiecare subnivel poate conține un număr specific de electroni․
Configurația electronică a unui element poate fi dedusă din poziția sa în tabelul periodic․ De exemplu, configurația electronică a oxigenului este $1s^22s^22p^4$․ Aceasta înseamnă că oxigenul are 2 electroni în nivelul de energie 1, 2 electroni în nivelul de energie 2 și 4 electroni în subnivelul p al nivelului de energie 2․
Configurația electronică este un instrument esențial pentru înțelegerea legăturilor chimice și a reacțiilor chimice․
Electronii de valență
Electronii de valență sunt electronii din ultimul nivel de energie al unui atom, aceștia fiind cei implicați în formarea legăturilor chimice․ Numărul de electroni de valență determină modul în care un element se va lega cu alte elemente․ De exemplu, oxigenul are 6 electroni, dintre care 2 sunt în nivelul de energie 1 și 4 în nivelul de energie 2․ Astfel, oxigenul are 6 electroni de valență․
Tabelul periodic poate fi folosit pentru a determina numărul de electroni de valență ai unui element․ Numărul grupului din tabelul periodic corespunde numărului de electroni de valență ai elementelor din acel grup․ De exemplu, elementele din grupa 1 (metalele alcaline) au un electron de valență, iar elementele din grupa 17 (halogenii) au 7 electroni de valență․
Înțelegerea electronilor de valență este esențială pentru a prezice modul în care elementele se leagă între ele și pentru a înțelege proprietățile chimice ale compușilor․
Clasificarea elementelor
Elementele din tabelul periodic sunt clasificate în metale, nemetale și metaloizi, în funcție de proprietățile lor chimice și fizice․
Metale, nemetale și metaloizi
Elementele din tabelul periodic sunt clasificate în trei categorii principale, în funcție de proprietățile lor chimice și fizice⁚ metale, nemetale și metaloizi․ Această clasificare este esențială pentru înțelegerea comportamentului elementelor în reacțiile chimice și pentru a prezice proprietățile compușilor pe care îi formează․
Metalele sunt elementele care se caracterizează printr-o conductivitate electrică și termică ridicată, maleabilitate (capacitatea de a fi deformate în foi subțiri), ductilitate (capacitatea de a fi trase în fire) și luciu metalic․ Ele se găsesc în partea stângă a tabelului periodic și includ elemente precum fierul (Fe), cuprul (Cu), aurul (Au) și argintul (Ag)․
Nemetalele, în contrast, sunt elementele care sunt în general rele conductoare de electricitate și căldură, sunt fragile și nu au luciu metalic․ Ele se găsesc în partea dreaptă a tabelului periodic și includ elemente precum oxigenul (O), azotul (N), clorul (Cl) și carbonul (C)․
Metaloizii, cunoscuți și ca semimetale, au proprietăți intermediare între metale și nemetale․ Ei prezintă o conductivitate electrică variabilă, în funcție de condițiile specifice, și pot fi găsiți atât în stare solidă, cât și în stare lichidă․ Exemple de metaloizi includ siliciul (Si), germaniu (Ge) și arsenul (As)․
Proprietățile elementelor
Tabelul periodic oferă o imagine de ansamblu a proprietăților chimice și fizice ale elementelor, organizându-le în funcție de aceste caracteristici․ Fiecare element este reprezentat printr-un simbol chimic, un număr atomic și o masă atomică, care oferă informații esențiale despre structura și comportamentul său․
Numărul atomic, reprezentat prin simbolul Z, indică numărul de protoni din nucleul unui atom; Masa atomică, reprezentată prin simbolul A, este o măsură a masei atomului, exprimată în unități de masă atomică (u․a․m․)․ Masa atomică este aproximativ egală cu suma numărului de protoni și neutroni din nucleu․
Proprietățile chimice ale unui element sunt determinate de configurația electronică a atomilor săi, adică modul în care electronii sunt aranjați în jurul nucleului․ Configurația electronică influențează modul în care un element se leagă cu alte elemente și formează compuși․
Tendințele periodice
Tabelul periodic prezintă o serie de tendințe periodice, adică variații sistematice ale proprietăților elementelor de-a lungul grupelor și perioadelor․ Aceste tendințe sunt esențiale pentru înțelegerea comportamentului chimic al elementelor și pentru predicția proprietăților lor․
O tendință importantă este raza atomică, care se referă la distanța medie dintre nucleul atomului și electronul cel mai exterior․ Radia atomică crește pe măsură ce coborâm într-o grupă și scade pe măsură ce ne deplasăm de-a lungul unei perioade․ Această tendință este explicată de creșterea numărului de niveluri de energie și de atracția mai puternică a nucleului asupra electronilor din perioadele inferioare․
O altă tendință importantă este electronegativitatea, care măsoară capacitatea unui atom de a atrage electroni într-o legătură chimică․ Electronegativitatea crește pe măsură ce ne deplasăm de-a lungul unei perioade și scade pe măsură ce coborâm într-o grupă․
Utilizarea tabelului periodic
Tabelul periodic este un instrument esențial pentru chimiști, oferind informații valoroase despre proprietățile elementelor și interacțiunile lor․
Determinarea proprietăților chimice
Tabelul periodic este o sursă bogată de informații despre proprietățile chimice ale elementelor․ Prin poziționarea unui element în tabel, putem deduce o serie de caracteristici importante․ De exemplu, numărul atomic al unui element, afișat în partea de sus a casetei sale, indică numărul de protoni din nucleul atomului․ Masa atomică, afișată în partea de jos a casetei, reprezintă masa medie a atomilor elementului respectiv, luând în considerare izotopii săi naturali․
Tabelul periodic ne ajută să înțelegem și tendințele periodice, cum ar fi electronegativitatea, energia de ionizare și afinitatea electronică․ Aceste tendințe ne permit să prezicem cum se vor comporta elementele în reacții chimice, precum și să comparăm reactivitatea lor․ De exemplu, elementele din aceeași grupă au tendința de a avea proprietăți chimice similare, datorită numărului lor egal de electroni de valență․
Predicția reacțiilor chimice
Tabelul periodic este un instrument esențial pentru predicția reacțiilor chimice․ Prin înțelegerea poziției elementelor în tabel și a tendințelor periodice, putem anticipa cum vor reacționa substanțele chimice între ele․ De exemplu, metalele alcaline din grupa 1 au tendința de a reacționa violent cu apa, eliberând hidrogen․
De asemenea, tabelul periodic ne ajută să înțelegem tipurile de legături chimice care se formează între atomi․ Elementele cu electronegativități similare au tendința de a forma legături covalente, în timp ce elementele cu electronegativități semnificativ diferite formează legături ionice․ Această informație este crucială pentru a prezice formula chimică a compușilor și pentru a înțelege proprietățile lor․
Stoichiometria și ecuațiile chimice
Tabelul periodic este esențial pentru înțelegerea stoichiometriei, care se ocupă de relațiile cantitative dintre reactanți și produșii unei reacții chimice․ Masa atomică a fiecărui element, prezentată în tabelul periodic, este crucială pentru calcularea masei moleculare a compușilor și pentru stabilirea raporturilor molare în ecuațiile chimice․
De exemplu, pentru a calcula masa molară a apei ($H_2O$), adunăm masele atomice ale celor doi atomi de hidrogen (1,008 u․a․m․ fiecare) și a unui atom de oxigen (15,999 u․a․m․), obținând 18,015 u․a․m․ Această informație ne permite să convertim între masa unui compus și numărul de moli, o unitate fundamentală în chimie․
Legăturile chimice
Tabelul periodic este o resursă valoroasă pentru înțelegerea legăturilor chimice, care țin atomii împreună pentru a forma molecule și compuși․ Electronii de valență, reprezentați în configurația electronică a fiecărui element, joacă un rol crucial în formarea legăturilor․ Electronegativitatea, o proprietate periodică, ne ajută să prezicem tipul de legătură chimică care se va forma între doi atomi․
De exemplu, elementele cu electronegativități similare, cum ar fi carbonul și hidrogenul, formează legături covalente, în care atomii împart electroni․ În schimb, elementele cu electronegativități semnificativ diferite, cum ar fi sodiul și clorul, formează legături ionice, în care un atom cedează un electron altui atom, formând ioni cu sarcini opuse․
Aplicații în știință, tehnologie și industrie
Tabelul periodic este un instrument esențial în diverse domenii, de la cercetarea științifică la dezvoltarea tehnologică și producția industrială․ În chimie, tabelul periodic facilitează predicția reacțiilor chimice, determinarea proprietăților compușilor și optimizarea proceselor chimice․ În știința materialelor, tabelul periodic este utilizat pentru a proiecta noi materiale cu proprietăți specifice, cum ar fi conductivitatea electrică, rezistența la coroziune sau rezistența la căldură․
În industrie, tabelul periodic este crucial pentru producția de medicamente, îngrășăminte, materiale plastice și multe alte produse esențiale․ De asemenea, este utilizat în domenii precum energia nucleară, agricultura și industria alimentară․ Înțelegerea tabelului periodic este esențială pentru a aborda provocările globale, cum ar fi găsirea de soluții sustenabile pentru energie, sănătate și mediu․
Concluzie
Tabelul periodic este un instrument esențial pentru înțelegerea chimiei, oferind o bază pentru studiul elementelor și al reacțiilor chimice․
Studierea tabelului periodic este crucială pentru o înțelegere profundă a chimiei și pentru a aplica cunoștințele în diverse domenii․
Rolul tabelului periodic în chimie
Tabelul periodic joacă un rol esențial în chimie, oferind un cadru fundamental pentru înțelegerea comportamentului elementelor și a interacțiunilor dintre acestea․ Organizarea elementelor în funcție de numărul atomic și de proprietățile lor chimice permite o predicție sistematică a reacțiilor chimice și a proprietăților compușilor․ De exemplu, cunoașterea poziției unui element în tabelul periodic permite predicția numărului de electroni de valență, a tendințelor de electronegativitate și a reactivității chimice․
Tabelul periodic este un instrument esențial pentru chimiști, facilitând înțelegerea legăturilor chimice, a reacțiilor chimice și a proprietăților materialelor․ Prin intermediul tabelului periodic, se poate prezice comportamentul elementelor în diverse condiții, ceea ce este esențial pentru dezvoltarea de noi materiale, medicamente și tehnologii․
Importanța studierii tabelului periodic
Studierea tabelului periodic este esențială pentru o înțelegere profundă a chimiei, oferind o bază solidă pentru explorarea lumii atomilor și a interacțiunilor dintre aceștia․ Prin studierea tabelului periodic, se dobândește o perspectivă asupra structurii atomilor, a modului în care electronii sunt aranjați în jurul nucleului și a impactului configurației electronice asupra proprietăților chimice․
Cunoașterea tabelului periodic permite predicția reacțiilor chimice, a proprietăților compușilor și a comportamentului elementelor în diverse condiții․ Această cunoaștere este esențială pentru o gamă largă de domenii, inclusiv chimie organică, chimie anorganică, chimie fizică, chimie industrială și cercetarea științifică․ Studierea tabelului periodic este o investiție în dezvoltarea gândirii științifice și în capacitatea de a analiza și de a interpreta informații chimice complexe․
Articolul prezintă o introducere clară și concisă a tabelului periodic, evidențiind importanța sa în chimie. Explicația structurii tabelului este ușor de înțeles, iar exemplele oferite sunt relevante. Cu toate acestea, ar fi utilă adăugarea unor informații suplimentare despre istoria descoperirii tabelului periodic, precum și despre contribuțiile unor savanți importanți în acest domeniu.
Articolul este informativ și bine documentat. Explicația despre electronii de valență este clară și concisă. Totuși, ar fi benefic să se menționeze și despre legăturile chimice, care sunt direct influențate de electronii de valență.
Articolul este o prezentare generală bună a tabelului periodic, dar ar putea fi îmbunătățit prin adăugarea unor informații despre descoperirea unor elemente specifice, cum ar fi aurul, argintul sau platina. Această secțiune ar putea prezenta istoria descoperirii acestor elemente și importanța lor în diverse domenii.
Articolul oferă o prezentare generală bună a tabelului periodic, dar ar putea fi îmbunătățit prin adăugarea unor exemple practice de utilizare a tabelului în rezolvarea problemelor de chimie. De asemenea, ar fi util să se menționeze despre tendințele periodice, cum ar fi electronegativitatea și energia de ionizare.
Articolul este o introducere excelentă în lumea tabelului periodic. Explicația despre proprietățile elementelor este clară și concisă. Ar fi util să se adauge o secțiune dedicată predicției reacțiilor chimice, care este una dintre cele mai importante aplicații ale tabelului periodic.
Articolul este bine scris și ușor de înțeles, dar ar fi util să se adauge o secțiune dedicată unor elemente specifice, cum ar fi metalele alcaline, metalele alcalino-pământoase sau halogenii. Această secțiune ar putea prezenta proprietățile specifice ale acestor elemente și importanța lor în diverse domenii.
Articolul este o introducere excelentă în tabelul periodic. Explicația despre structura tabelului este clară și concisă. Ar fi util să se adauge o secțiune dedicată unor resurse online utile pentru a aprofunda cunoștințele despre tabelul periodic.
Articolul este bine scris și ușor de înțeles, dar ar fi util să se adauge o secțiune dedicată aplicațiilor practice ale tabelului periodic în diferite domenii, cum ar fi industria, medicina sau agricultura.
Articolul este bine structurat și ușor de citit. Explicația despre numărul atomic și masa atomică este clară și concisă. Totuși, ar fi benefic să se menționeze și despre conceptul de izotopi, care este strâns legat de masa atomică.