Tabelul periodic al elementelor
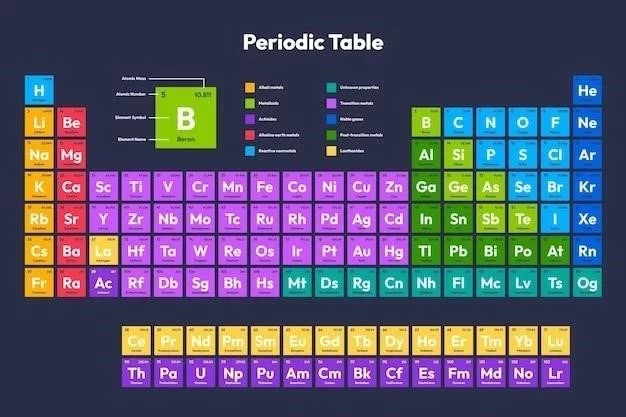

Tabelul periodic al elementelor este o reprezentare grafică a tuturor elementelor chimice cunoscute, organizate în funcție de numărul lor atomic, proprietățile lor chimice și configurația electronică․
Tabelul periodic al elementelor este o reprezentare grafică a tuturor elementelor chimice cunoscute, organizate în funcție de numărul lor atomic, proprietățile lor chimice și configurația electronică․ Această organizare sistematică permite o înțelegere mai profundă a legăturilor dintre elemente și a modului în care acestea interacționează între ele․ Elementele sunt aranjate în funcție de creșterea numărului atomic, care reprezintă numărul de protoni din nucleul unui atom․ Tabelul periodic este împărțit în perioade și grupe, reflectând tendințele periodice ale proprietăților chimice ale elementelor․
Introducere
Prezentarea generală a tabelului periodic
Tabelul periodic al elementelor este o reprezentare grafică a tuturor elementelor chimice cunoscute, organizate în funcție de numărul lor atomic, proprietățile lor chimice și configurația electronică․ Această organizare sistematică permite o înțelegere mai profundă a legăturilor dintre elemente și a modului în care acestea interacționează între ele․ Elementele sunt aranjate în funcție de creșterea numărului atomic, care reprezintă numărul de protoni din nucleul unui atom․ Tabelul periodic este împărțit în perioade și grupe, reflectând tendințele periodice ale proprietăților chimice ale elementelor․
Tabelul periodic este un instrument esențial în chimie, oferind o bază pentru înțelegerea și prezicerea proprietăților chimice ale elementelor․ El permite chimiștilor să prezică reacțiile chimice, să identifice elementele cu proprietăți similare și să dezvolte noi materiale și tehnologii․ Organizarea tabelului periodic reflectă legile fundamentale ale chimiei, cum ar fi legea periodicității, care descrie variația periodică a proprietăților chimice ale elementelor․ Studiul tabelului periodic este fundamental pentru o înțelegere aprofundată a chimiei․
Organizarea tabelului periodic
Tabelul periodic este organizat în funcție de numărul atomic, masa atomică, configurația electronică și proprietățile chimice ale elementelor․
Numărul atomic și masa atomică
Numărul atomic ($Z$) al unui element reprezintă numărul de protoni din nucleul atomului respectiv․ Acesta este un număr întreg pozitiv și determină identitatea elementului․ De exemplu, hidrogenul are un număr atomic de 1, iar oxigenul are un număr atomic de 8․ Numărul atomic este principalul criteriu de organizare a tabelului periodic, elementele fiind aranjate în ordine crescătoare a numărului atomic․
Masa atomică ($A$) a unui element reprezintă masa medie a atomilor unui element, exprimată în unități de masă atomică (u․m․a․)․ Masa atomică este influențată de numărul de protoni și neutroni din nucleul atomului․ De obicei, masa atomică a unui element este un număr zecimal, deoarece este o medie ponderată a maselor izotopilor elementului respectiv․
Grupe și perioade
Elementele din tabelul periodic sunt organizate în coloane verticale numite grupe și în rânduri orizontale numite perioade․ Elementele din aceeași grupă au configurații electronice similare în stratul lor de valență, ceea ce le conferă proprietăți chimice asemănătoare․ De exemplu, metalele alcaline (grupul 1) au toate un electron de valență, ceea ce le conferă reactivitate chimică ridicată․ Elementele din aceeași perioadă au același număr de straturi electronice, ceea ce determină o variație a proprietăților chimice de-a lungul perioadei․
Tabelul periodic este împărțit în 18 grupe, numerotate de la 1 la 18․ Există 7 perioade, numerotate de la 1 la 7․ Numărul perioadei corespunde nivelului energetic principal al electronilor de valență ai elementelor din acea perioadă․
Metale, nemetale și metaloizi
Elementele din tabelul periodic pot fi clasificate în trei categorii principale⁚ metale, nemetale și metaloizi․ Metalele sunt caracterizate prin luciu metalic, conductivitate electrică și termică bună, maleabilitate și ductilitate․ Ele se găsesc în stânga și în centrul tabelului periodic․ Nemetalele sunt în general solide fragile, conduc slab căldura și electricitatea și nu sunt maleabile sau ductile․ Ele se găsesc în partea dreaptă a tabelului periodic․ Metaloizii, cunoscuți și sub numele de semimetale, au proprietăți intermediare între metale și nemetale․ Ele se găsesc pe o linie diagonală care separă metalele de nemetale․
Această clasificare este utilă pentru a înțelege proprietățile chimice și fizice ale elementelor și pentru a prezice modul în care ele vor reacționa cu alte elemente․
Tendințe în tabelul periodic
Tabelul periodic prezintă tendințe sistematice în proprietățile chimice și fizice ale elementelor․
Configurația electronică
Configurația electronică a unui element descrie modul în care electronii sunt aranjați în jurul nucleului atomic․ Această configurație este determinată de numărul atomic al elementului și este reprezentată printr-o notație specifică․ De exemplu, configurația electronică a atomului de sodiu (Na) este 1s22s22p63s1, indicând prezența a 11 electroni aranjați pe diferite niveluri de energie․ Configurația electronică explică multe proprietăți chimice ale elementelor, inclusiv reactivitatea și tendința de a forma legături chimice․
Proprietățile chimice
Proprietățile chimice ale elementelor sunt determinate de configurația electronică a atomilor lor․ Acestea descriu cum un element reacționează cu alte substanțe și includ⁚ reactivitatea, electronegativitatea, energia de ionizare și afinitatea electronică․ Reactivitatea se referă la tendința unui element de a participa la reacții chimice․ Electronegativitatea măsoară capacitatea unui atom de a atrage electroni într-o legătură chimică․ Energia de ionizare este energia necesară pentru a elimina un electron dintr-un atom․ Afinitatea electronică este energia eliberată atunci când un atom captează un electron․ Aceste proprietăți chimice variază periodic în tabelul periodic, reflectând tendințele în configurația electronică a elementelor․
Reactivitatea
Reactivitatea unui element se referă la ușurința cu care acesta formează legături chimice cu alte elemente․ În general, elementele din stânga tabelului periodic, cum ar fi metalele alcaline, sunt foarte reactive, în timp ce elementele din dreapta, cum ar fi gazele nobile, sunt foarte puțin reactive․ Această tendință este legată de configurația electronică a atomilor⁚ elementele cu un singur electron de valență, cum ar fi metalele alcaline, tind să îl cedeze cu ușurință, formând legături ionice․ Pe de altă parte, elementele cu o configurație electronică stabilă, cum ar fi gazele nobile, au o reactivitate foarte scăzută․ Reactivitatea variază, de asemenea, în cadrul unei perioade, crescând de la stânga la dreapta, cu excepția gazelor nobile․
Electronegativitatea
Electronegativitatea este o măsură a tendinței unui atom de a atrage electroni într-o legătură chimică․ Elementele din dreapta sus a tabelului periodic, cum ar fi fluorul și oxigenul, au electronegativități ridicate, în timp ce elementele din stânga jos, cum ar fi cesiul și franciul, au electronegativități scăzute․ Această tendință este legată de atracția nucleului atomic pentru electronii de valență⁚ atomii cu o sarcină nucleară mai mare și o rază atomică mai mică au o electronegativitate mai mare․ Electronegativitatea este un factor important în determinarea tipului de legătură chimică formată între doi atomi⁚ o diferență mare de electronegativitate conduce la o legătură ionică, în timp ce o diferență mică conduce la o legătură covalentă․
Energia de ionizare
Energia de ionizare este energia minimă necesară pentru a elimina un electron dintr-un atom aflat în starea sa fundamentală gazoasă․ Această energie este o măsură a atracției nucleului pentru electronii de valență․ Energia de ionizare crește de-a lungul unei perioade din tabelul periodic, deoarece sarcina nucleară crește, iar electronii de valență sunt mai strâns legați de nucleu․ Energia de ionizare scade pe o coloană, deoarece raza atomică crește, iar electronii de valență sunt mai îndepărtați de nucleu și mai ușor de îndepărtat․ Energia de ionizare este un factor important în determinarea reactivității unui element⁚ elementele cu energii de ionizare scăzute sunt mai reactive, deoarece pierd mai ușor electroni și formează cationi․
Raza atomică
Raza atomică este o măsură a dimensiunii unui atom․ Această dimensiune este determinată de distanța medie dintre nucleul atomului și electronul său cel mai exterior․ Raza atomică scade de-a lungul unei perioade din tabelul periodic, deoarece sarcina nucleară crește, iar electronii de valență sunt mai strâns legați de nucleu, ceea ce duce la o atracție mai puternică și o dimensiune mai mică a atomului․ Raza atomică crește pe o coloană din tabelul periodic, deoarece numărul de nivele de energie crește, ceea ce duce la un volum atomic mai mare․ Raza atomică este un factor important în determinarea proprietăților chimice ale unui element, inclusiv reactivitatea și tipul de legături chimice pe care le poate forma․
Familii chimice
Elementele din tabelul periodic sunt grupate în familii chimice, care au proprietăți chimice similare datorită configurațiilor electronice asemănătoare․
Metale alcaline
Metalele alcaline sunt elementele din grupa 1 a tabelului periodic, cu excepția hidrogenului․ Acestea includ litiu (Li), sodiu (Na), potasiu (K), rubidiu (Rb), cesiu (Cs) și franciu (Fr)․ Metalele alcaline sunt caracterizate printr-o reactivitate chimică ridicată, datorită configurației electronice exterioare $ns^1$, care le permite să cedeze ușor un electron și să formeze cationi monovalenți․ Aceste elemente sunt moi, de culoare argintie și au puncte de topire și fierbere scăzute․ Metalele alcaline sunt foarte reactive cu apa, generând hidrogen gazos și o soluție bazică․ Reacția cu apa este exotermă și poate fi explozivă în cazul elementelor mai grele, cum ar fi potasiul și rubidiul․ Metalele alcaline sunt utilizate în diverse aplicații, inclusiv baterii, lămpi cu descărcare în gaz și reactivi chimici․
Metale alcalino-pământoase
Metalele alcalino-pământoase sunt elementele din grupa 2 a tabelului periodic․ Acestea includ beriliu (Be), magneziu (Mg), calciu (Ca), stronțiu (Sr), bariu (Ba) și radiu (Ra)․ Metalele alcalino-pământoase au configurația electronică exterioară $ns^2$, ceea ce le conferă o reactivitate chimică mai scăzută decât metalele alcaline, dar totuși semnificativă․ Aceste elemente sunt mai dure și au puncte de topire și fierbere mai ridicate decât metalele alcaline․ Metalele alcalino-pământoase sunt utilizate în diverse aplicații, inclusiv în industria metalurgică, în producția de materiale de construcție, în fabricarea de baterii și în diverse procese chimice․ De exemplu, magneziul este utilizat în fabricarea de aliaje ușoare, calciul este folosit în producția de ciment și mortar, iar bariul este utilizat în fabricarea de pigmenți și în diverse aplicații medicale․
Halogeni
Halogenii sunt elementele din grupa 17 a tabelului periodic․ Aceștia includ fluorul (F), clorul (Cl), bromul (Br), iodul (I) și astatul (At)․ Halogenii au configurația electronică exterioară $ns^2np^5$, ceea ce le conferă o reactivitate chimică ridicată․ Halogenii sunt nemetale, cu excepția astatului, care este un metaloid․ Aceste elemente sunt foarte reactive și formează cu ușurință compuși cu metalele․ Halogenii sunt utilizați în diverse aplicații, inclusiv în industria chimică, în fabricarea de dezinfectanți, în producția de pesticide și în diverse procese medicale․ De exemplu, clorul este utilizat în purificarea apei potabile, bromul este folosit în fabricarea de substanțe ignifuge, iar iodul este utilizat în diverse aplicații medicale, inclusiv în tratamentul deficienței de iod․
Gaze nobile
Gaze nobile, cunoscute și sub numele de gaze rare, sunt elementele din grupa 18 a tabelului periodic․ Acestea includ heliul (He), neonul (Ne), argonul (Ar), kriptonul (Kr), xenonul (Xe) și radonul (Rn)․ Gaze nobile au o configurație electronică exterioară completă, $ns^2np^6$, ceea ce le conferă o stabilitate chimică extrem de ridicată․ Această stabilitate se datorează faptului că au un octet complet de electroni în ultimul strat electronic, ceea ce le face foarte puțin reactive․ Gaze nobile sunt incolore, inodore și insipide în condiții standard․ Ele sunt folosite în diverse aplicații, inclusiv în iluminat, în lasere, în imagistica medicală și în diverse procese industriale․ De exemplu, heliul este utilizat în baloane și în diverse aplicații științifice, neonul este utilizat în reclame luminoase, iar argonul este utilizat în diverse procese industriale, inclusiv în sudură și în fabricarea de becuri․
Metale de tranziție
Metalele de tranziție se află în grupele 3-12 ale tabelului periodic․ Ele sunt caracterizate prin electroni de valență în orbitalii d, ceea ce le conferă proprietăți chimice și fizice unice․ Aceste metale sunt, în general, dure, rezistente, bune conductoare de căldură și electricitate și au puncte de topire și de fierbere ridicate․ De asemenea, ele prezintă o varietate de stări de oxidare, ceea ce le permite să formeze o gamă largă de compuși․ Metalele de tranziție joacă un rol esențial în diverse procese biologice, industriale și tehnologice․ De exemplu, fierul este un element esențial pentru transportul oxigenului în sânge, iar cuprul este utilizat în cabluri electrice și în diverse aliaje․ Metalele de tranziție sunt, de asemenea, utilizate în cataliză, în fabricarea de pigmenți și în diverse alte aplicații․
Lantanide și actinide
Lantanidele și actinidele sunt două serii de elemente chimice care se află în partea de jos a tabelului periodic, sub tabelul principal․ Lantanidele, cunoscute și sub numele de metale rare ale pământurilor, sunt situate în perioada a 6-a, iar actinidele în perioada a 7-a․ Aceste elemente au o configurație electronică caracteristică, cu electroni de valență în orbitalii f․ Ele prezintă proprietăți chimice similare, dar se diferențiază prin reactivitatea lor․ Lantanidele sunt mai reactive decât actinidele, care sunt radioactive și au o durată de viață scurtă․ Lantanidele sunt utilizate în diverse aplicații, cum ar fi în fabricarea de magneți permanenți, în iluminat și în diverse aliaje․ Actinidele sunt utilizate în reactoarele nucleare și în diverse aplicații medicale․
Legea periodicității
Legea periodicității afirmă că proprietățile chimice ale elementelor variază periodic în funcție de numărul lor atomic․
Contribuția lui Mendeleev
Dmitri Mendeleev, un chimist rus, este considerat creatorul tabelului periodic modern․ În 1869, el a publicat prima versiune a tabelului periodic, organizând elementele în funcție de masa lor atomică crescătoare․ Mendeleev a observat că proprietățile chimice ale elementelor se repetă periodic și a lăsat spații goale în tabelul său pentru elementele necunoscute la acea vreme, prezicând cu acuratețe proprietățile lor․ Această predicție a fost confirmată ulterior prin descoperirea elementelor lipsă, consolidând astfel validitatea tabelului periodic․
Contribuția lui Moseley
Henry Moseley, un fizician britanic, a adus o contribuție esențială la înțelegerea organizării tabelului periodic․ În 1913, el a folosit razele X pentru a determina numărul atomic al elementelor, demonstrând că acesta este o proprietate fundamentală a atomilor․ Moseley a arătat că numărul atomic, nu masa atomică, este factorul determinant al poziției unui element în tabelul periodic․ Această descoperire a clarificat anomaliile din tabelul lui Mendeleev, cum ar fi inversarea poziției potasiului și a argonului, și a oferit o bază mai solidă pentru organizarea elementelor․
Evoluția tabelului periodic
Tabelul periodic a suferit o serie de modificări și îmbunătățiri de-a lungul timpului, reflectând progresele înțelegerii structurii atomului și a proprietăților elementelor․ După contribuția lui Moseley, tabelul periodic a fost organizat în funcție de numărul atomic crescător, ceea ce a dus la o organizare mai logică și mai precisă․ Descoperirea elementelor radioactive și a elementelor transuraniene a condus la extinderea tabelului periodic, cu adăugarea de noi perioade și grupe․ De asemenea, dezvoltarea mecanicii cuantice a oferit o explicație mai profundă a configurației electronice a elementelor, contribuind la o mai bună înțelegere a tendințelor periodice․
Concluzie
Tabelul periodic este un instrument esențial în chimie, oferind o imagine de ansamblu a elementelor și a proprietăților lor, facilitând predicția comportamentului lor chimic․
Importanța tabelului periodic în chimie
Tabelul periodic este un instrument indispensabil în chimie, oferind o bază fundamentală pentru înțelegerea proprietăților și comportamentului elementelor․ Organizarea elementelor în funcție de numărul atomic și de proprietățile lor chimice permite predicția reacțiilor chimice, a proprietăților compușilor și a comportamentului elementelor în diverse condiții․ Tabelul periodic este un instrument de predicție și de organizare a cunoștințelor chimice, facilitând înțelegerea legăturilor chimice, a reacțiilor chimice și a proprietăților materialelor․ De asemenea, tabelul periodic este un instrument esențial în cercetarea științifică, ajutând la identificarea elementelor noi, la dezvoltarea de noi materiale și la înțelegerea proceselor chimice complexe․ Importanța tabelului periodic în chimie este incontestabilă, oferind un cadru unificat pentru studiul și înțelegerea lumii chimice․
Aplicații ale tabelului periodic
Tabelul periodic are o gamă largă de aplicații practice în diverse domenii, de la chimia industrială la medicina modernă․ În industria chimică, tabelul periodic este utilizat pentru a selecta elementele potrivite pentru fabricarea de materiale noi, cum ar fi polimeri, aliaje metalice și catalizatori․ În domeniul medical, tabelul periodic este esențial pentru dezvoltarea de noi medicamente și tratamente, identificând elementele cu proprietăți terapeutice specifice․ De asemenea, tabelul periodic este utilizat în geologie pentru a analiza compoziția rocilor și a mineralelor, în agricultura pentru a studia nutriția plantelor și în cercetarea nucleară pentru a studia elementele radioactive․ Aplicațiile tabelului periodic sunt vaste și diverse, reflectând importanța sa în înțelegerea și manipularea lumii materiale․
Viitorul tabelului periodic
Viitorul tabelului periodic este strâns legat de progresele în fizica nucleară și în sinteza elementelor transuraniene․ Descoperirea de noi elemente, cu numere atomice din ce în ce mai mari, va necesita o adaptare a tabelului periodic pentru a le integra․ Se anticipează că în viitorul apropiat vor fi descoperite noi elemente supergrele, extinzând tabelul periodic și explorând noi proprietăți chimice și fizice․ De asemenea, cercetările în domeniul chimiei computaționale pot contribui la o înțelegere mai profundă a comportamentului elementelor și la o predicție mai precisă a proprietăților lor․ Tabelul periodic va continua să evolueze, reflectând progresele științifice și oferind o platformă pentru explorarea misterelor lumii atomice․
Articolul oferă o prezentare clară și concisă a tabelului periodic, evidențiând importanța sa în chimie. Apreciez modul în care sunt explicate proprietățile chimice ale elementelor, precum și legătura dintre tabelul periodic și legile fundamentale ale chimiei. Totuși, ar fi util să se includă o secțiune cu o discuție mai aprofundată a modului în care tabelul periodic este utilizat în cercetarea științifică, pentru a oferi o perspectivă mai amplă asupra aplicațiilor practice ale acestei reprezentări.
Articolul oferă o prezentare clară și concisă a tabelului periodic, evidențiind importanța sa în chimie. Apreciez modul în care sunt explicate proprietățile chimice ale elementelor, precum și legătura dintre tabelul periodic și legile fundamentale ale chimiei. Totuși, ar fi util să se includă o secțiune cu o discuție mai aprofundată a modului în care tabelul periodic este utilizat în cercetarea științifică, pentru a oferi o perspectivă mai amplă asupra aplicațiilor practice ale acestei reprezentări.
Articolul prezintă o introducere clară și concisă a tabelului periodic al elementelor, evidențiând importanța sa în chimie. Apreciez modul în care sunt explicate organizarea și structura tabelului, precum și legătura dintre numărul atomic, proprietățile chimice și configurația electronică a elementelor. Totuși, ar fi util să se adauge o secțiune dedicată istoriei descoperirii și dezvoltării tabelului periodic, pentru a oferi o perspectivă mai amplă asupra evoluției acestei reprezentări fundamentale în chimie.
Articolul este bine scris și ușor de înțeles, oferind o introducere cuprinzătoare a tabelului periodic. Apreciez modul în care sunt prezentate perioadele și grupele, precum și legătura dintre organizarea tabelului periodic și proprietățile chimice ale elementelor. Totuși, ar fi util să se adauge o secțiune cu o discuție mai aprofundată a excepțiilor de la tendințele periodice, pentru a oferi o perspectivă mai completă asupra complexității tabelului periodic.
Articolul prezintă o introducere clară și concisă a tabelului periodic al elementelor, evidențiind importanța sa în chimie. Apreciez modul în care sunt explicate organizarea și structura tabelului, precum și legătura dintre numărul atomic, proprietățile chimice și configurația electronică a elementelor. Totuși, ar fi util să se adauge o secțiune dedicată istoriei descoperirii și dezvoltării tabelului periodic, pentru a oferi o perspectivă mai amplă asupra evoluției acestei reprezentări fundamentale în chimie.
Articolul oferă o prezentare excelentă a tabelului periodic, subliniind rolul său esențial în înțelegerea și prezicerea proprietăților chimice ale elementelor. Apreciez modul în care sunt explicate tendințele periodice ale proprietăților chimice, precum și legătura dintre tabelul periodic și legile fundamentale ale chimiei. Totuși, ar fi util să se includă o secțiune cu exemple concrete de aplicații ale tabelului periodic în diverse domenii, cum ar fi industria farmaceutică, tehnologia materialelor sau chimia mediului.
Articolul este bine structurat și ușor de citit, oferind o introducere cuprinzătoare a tabelului periodic. Apreciez modul în care sunt explicate tendințele periodice ale proprietăților chimice, precum și legătura dintre tabelul periodic și configurația electronică a elementelor. Totuși, ar fi util să se adauge o secțiune cu o discuție mai aprofundată a modului în care tabelul periodic este utilizat în predarea chimiei, pentru a oferi o perspectivă mai amplă asupra rolului său didactic.