Tabelul periodic colorat: Electronii de valență și culoarea
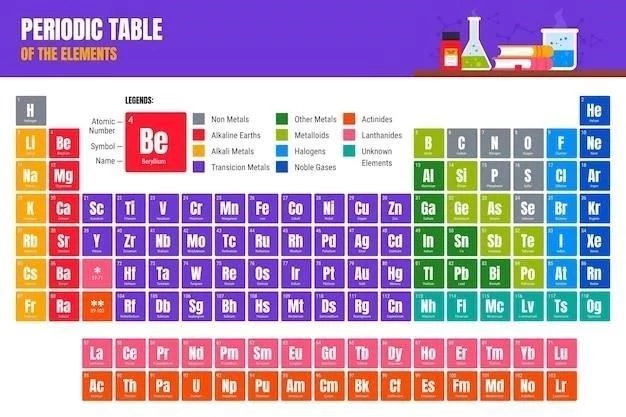

Electronii de valență și culoarea
Un tabel periodic colorat utilizează culori pentru a reprezenta numărul de electroni de valență ai fiecărui element, oferind o vizualizare intuitivă a tendințelor chimice.
Introducere
Tabelul periodic al elementelor este un instrument esențial în chimie, oferind o organizare sistematică a elementelor chimice în funcție de proprietățile lor. Fiecare element este identificat prin numărul său atomic, care reprezintă numărul de protoni din nucleul atomului său. Tabelul periodic este structurat în grupe (coloane) și perioade (linii), reflectând tendințele periodice ale proprietăților chimice ale elementelor. O reprezentare vizuală a tabelului periodic, care utilizează culori pentru a codifica proprietățile chimice ale elementelor, poate facilita înțelegerea și memorarea acestor tendințe. Un tabel periodic colorat bazat pe electronii de valență și sarcina ionică poate fi deosebit de util în studierea legăturilor chimice și a reacțiilor chimice.
Tabelul periodic al elementelor este o hartă a tuturor elementelor chimice cunoscute, aranjate în funcție de numărul lor atomic crescător. Acesta este organizat în șapte perioade (linii orizontale) și 18 grupe (coloane verticale). Elementele din aceeași grupă au același număr de electroni de valență, ceea ce le conferă proprietăți chimice similare. Perioadele reflectă numărul de nivele de energie ale electronilor din atomi. Tabelul periodic este un instrument esențial pentru chimiști, deoarece permite predicția comportamentului chimic al elementelor și înțelegerea legăturilor dintre ele. Un tabel periodic colorat, care codifică proprietățile chimice ale elementelor, poate fi un instrument didactic util pentru vizualizarea și memorarea tendințelor periodice.
Elementele ⎻ Blocurile de construcție ale materiei
Elementele chimice sunt substanțe pure care nu pot fi descompuse în substanțe mai simple prin mijloace chimice. Acestea sunt blocurile de construcție ale tuturor substanțelor din univers. Fiecare element este caracterizat printr-un număr atomic unic, care reprezintă numărul de protoni din nucleul atomului său. De exemplu, hidrogenul (H) are un număr atomic de 1, ceea ce înseamnă că are un singur proton în nucleu. Elementele sunt clasificate în funcție de proprietățile lor chimice și fizice, iar tabelul periodic reflectă aceste clasificări.
Numărul atomic și organizarea tabelului periodic
Tabelul periodic este organizat în funcție de numărul atomic al elementelor; Elementele sunt aranjate în ordine crescătoare a numărului atomic, de la stânga la dreapta și de sus în jos. Această organizare reflectă structura electronică a atomilor, care determină proprietățile chimice ale elementelor. Elementele cu proprietăți chimice similare sunt grupate în coloane verticale numite grupe sau familii. Elementele din aceeași perioadă (linie orizontală) au același număr de straturi electronice. Această organizare permite o înțelegere mai profundă a relațiilor dintre elemente și a comportamentului lor chimic.
Tabelul periodic⁚ o privire de ansamblu
Grupe și perioade⁚ ordonarea elementelor
Tabelul periodic este organizat în coloane verticale, numite grupe, și linii orizontale, numite perioade. Elementele din aceeași grupă au același număr de electroni de valență, ceea ce le conferă proprietăți chimice similare. De exemplu, elementele din grupa 1 (metalele alcaline) au un singur electron de valență, ceea ce le face foarte reactive. Elementele din aceeași perioadă au același număr de straturi electronice, ceea ce influențează dimensiunea atomilor și proprietățile lor chimice. De exemplu, elementele din perioada 2 au doi straturi electronice, în timp ce elementele din perioada 3 au trei straturi electronice.
Electronii de valență⁚ jucătorii cheie în legătura chimică
Electronii de valență sunt electronii care se află pe ultimul strat electronic al unui atom și sunt cei care participă la formarea legăturilor chimice. Numărul de electroni de valență determină capacitatea unui element de a forma legături chimice și, prin urmare, proprietățile sale chimice. De exemplu, un atom de carbon are patru electroni de valență, ceea ce îi permite să formeze patru legături covalente cu alți atomi. Această capacitate de a forma legături multiple explică diversitatea compușilor organici.
Electronii de valență⁚ jucătorii cheie în legătura chimică
Electronii de valență sunt electronii care se află pe ultimul strat electronic al unui atom și sunt cei care participă la formarea legăturilor chimice. Numărul de electroni de valență determină capacitatea unui element de a forma legături chimice și, prin urmare, proprietățile sale chimice. De exemplu, un atom de carbon are patru electroni de valență, ceea ce îi permite să formeze patru legături covalente cu alți atomi. Această capacitate de a forma legături multiple explică diversitatea compușilor organici.
Configurația electronică și determinarea electronilor de valență
Configurația electronică a unui element descrie distribuția electronilor în jurul nucleului atomic. Prin analiza configurației electronice, putem identifica electronii de valență. Aceștia sunt electronii care ocupă ultimul strat electronic, notat cu numărul cuantic principal *n*. De exemplu, configurația electronică a carbonului este *1s22s22p2, indicând doi electroni pe stratul n=1* și patru electroni pe stratul n=2. Prin urmare, carbonul are patru electroni de valență.
Valence și sarcină
Sarcina ionică⁚ echilibrarea forțelor
Sarcina ionică a unui element este o măsură a dezechilibrului dintre numărul de protoni din nucleu și numărul de electroni din jurul acestuia. Atomii tind să câștige sau să piardă electroni pentru a obține o configurație electronică stabilă, similară cu cea a gazelor nobile. Această tendință determină formarea ionilor cu sarcini pozitive (cationi) sau negative (anioni). De exemplu, sodiul (Na) are un electron de valență și tinde să îl piardă, formând ionul Na+ cu sarcină +1. Clorul (Cl) are șapte electroni de valență și tinde să câștige un electron, formând ionul Cl– cu sarcină -1.
Tabelul periodic colorat este o reprezentare vizuală a elementelor care utilizează culori pentru a codifica proprietățile chimice importante. Aceste culori sunt asociate cu diverse caracteristici ale elementelor, cum ar fi numărul de electroni de valență, sarcina ionică, electronegativitatea și starea de oxidare. Prin utilizarea culorilor, tabelul periodic devine un instrument intuitiv și ușor de utilizat pentru înțelegerea tendințelor chimice și a relațiilor dintre elemente.
Electronii de valență și culoarea
O metodă comună de codificare a culorilor în tabelul periodic se bazează pe numărul de electroni de valență ai fiecărui element. Electronii de valență sunt electronii din stratul exterior al atomului, care sunt implicați în formarea legăturilor chimice. De exemplu, elementele din grupa 1, cum ar fi litiu (Li) și sodiu (Na), au un singur electron de valență și ar putea fi reprezentate cu o culoare specifică, în timp ce elementele din grupa 2, cum ar fi beriliu (Be) și magneziu (Mg), au doi electroni de valență și ar putea fi reprezentate cu o altă culoare. Această codificare a culorilor permite o vizualizare rapidă a tendințelor în numărul de electroni de valență în cadrul tabelului periodic.
Sarcina și culoarea
Un tabel periodic colorat poate utiliza, de asemenea, culori pentru a reprezenta sarcina ionică a elementelor. Sarcina ionică este o măsură a încărcăturii electrice a unui atom, care este determinată de numărul de electroni câștigați sau pierduți. Metalele tind să piardă electroni și să formeze ioni pozitivi, în timp ce nemetalele tind să câștige electroni și să formeze ioni negativi; De exemplu, elementele din grupa 1, cum ar fi Li și Na, au o sarcină ionică de +1, în timp ce elementele din grupa 17, cum ar fi fluorul (F) și clorul (Cl), au o sarcină ionică de -1. Codificarea culorilor pentru sarcina ionică permite o vizualizare rapidă a tendințelor în tendința elementelor de a forma ioni și de a participa la legături ionice.
Tabelul periodic colorat⁚ o vizualizare a proprietăților chimice
Utilizarea tabelului periodic colorat
Utilizarea unui tabel periodic colorat poate facilita înțelegerea și memorarea proprietăților chimice ale elementelor. De exemplu, identificarea rapidă a elementelor cu aceleași numere de electroni de valență poate ajuta la prezicerea comportamentului lor chimic. De asemenea, poate fi util în predarea chimiei la nivel de liceu și universitar, făcând vizualizarea și înțelegerea conceptului de electroni de valență mai ușoară. Un tabel periodic colorat poate fi un instrument valoros pentru elevii și profesorii de chimie, oferind o reprezentare vizuală intuitivă a proprietăților chimice ale elementelor.
Tabelul periodic prezintă o serie de tendințe periodice, adică variații sistematice ale proprietăților chimice ale elementelor în funcție de poziția lor în tabel. Aceste tendințe sunt determinate de configurația electronică a atomilor, în special de numărul și aranjarea electronilor de valență. Printre cele mai importante tendințe periodice se numără⁚ radia atomică, energia de ionizare, afinitatea electronică și electronegativitatea. Aceste tendințe sunt esențiale pentru înțelegerea comportamentului chimic al elementelor și pentru prezicerea reacțiilor chimice.
Radia atomică
Radia atomică este o măsură a dimensiunii unui atom, definita ca distanța medie dintre nucleul atomului și electronul cel mai exterior. În tabelul periodic, radia atomică crește de sus în jos în cadrul unei grupe, deoarece numărul de straturi de electroni crește. De asemenea, radia atomică scade de la stânga la dreapta în cadrul unei perioade, deoarece sarcina nucleară crește, atragând electronii mai aproape de nucleu. Această tendință este vizibilă în tabelul periodic colorat, unde elementele cu radia atomică mai mare sunt reprezentate cu culori mai deschise, iar elementele cu radia atomică mai mică cu culori mai închise.
Energia de ionizare
Energia de ionizare este energia minimă necesară pentru a elimina un electron dintr-un atom gazos în starea sa fundamentală. În tabelul periodic, energia de ionizare crește de la stânga la dreapta în cadrul unei perioade, deoarece sarcina nucleară crește, ceea ce face mai dificilă îndepărtarea unui electron de la un atom. Energia de ionizare scade de sus în jos în cadrul unei grupe, deoarece electronul care este îndepărtat este mai departe de nucleu și este mai puțin strâns legat. Această tendință este reflectată în tabelul periodic colorat, unde elementele cu energie de ionizare mai mare sunt reprezentate cu culori mai închise, iar elementele cu energie de ionizare mai mică cu culori mai deschise.
Afinitatea electronică
Afinitatea electronică este energia eliberată atunci când un atom gazos în starea sa fundamentală captează un electron pentru a forma un ion negativ. În general, afinitatea electronică crește de la stânga la dreapta în cadrul unei perioade, deoarece sarcina nucleară crește, ceea ce face ca atomul să fie mai atractiv pentru un electron suplimentar. Afinitatea electronică scade de sus în jos în cadrul unei grupe, deoarece electronul adăugat este mai departe de nucleu și este mai puțin atractiv; Un tabel periodic colorat poate reprezenta afinitatea electronică prin utilizarea de culori mai închise pentru elementele cu afinitate electronică mai mare și culori mai deschise pentru elementele cu afinitate electronică mai mică.
Electronegativitatea
Electronegativitatea este o măsură a atracției unui atom pentru electronii din legătura chimică. Electronegativitatea crește de la stânga la dreapta în cadrul unei perioade, deoarece sarcina nucleară crește, ceea ce face ca atomul să fie mai atractiv pentru electronii din legătură. Electronegativitatea scade de sus în jos în cadrul unei grupe, deoarece electronii de valență sunt mai departe de nucleu și sunt mai puțin atrași de acesta. Un tabel periodic colorat poate reprezenta electronegativitatea prin utilizarea de culori mai închise pentru elementele cu electronegativitate mai mare și culori mai deschise pentru elementele cu electronegativitate mai mică. Electronegativitatea este un concept important în chimia legăturii, deoarece influențează polaritatea legăturilor chimice și tipul de legături care se formează.
Tendințele periodice
Starea de oxidare
Starea de oxidare a unui element este o măsură a sarcinii sale aparente într-o moleculă sau ion. Este un număr întreg care poate fi pozitiv, negativ sau zero. Starea de oxidare poate fi utilizată pentru a prezice comportamentul chimic al unui element și pentru a echilibra ecuațiile chimice. Un tabel periodic colorat poate reprezenta starea de oxidare prin utilizarea de culori diferite pentru elementele cu stări de oxidare diferite. De exemplu, elementele din grupa 1 au o stare de oxidare de +1, elementele din grupa 2 au o stare de oxidare de +2, iar elementele din grupa 17 au o stare de oxidare de -1. Starea de oxidare este un concept important în chimia anorganică și este utilizată pe scară largă în chimia organică.
Tabelul periodic al elementelor ⎻ O reprezentare vizuală a chimiei
Concluzie
Tabelul periodic colorat este un instrument vizual puternic care facilitează înțelegerea proprietăților chimice ale elementelor. Prin codificarea informațiilor despre electronii de valență, sarcina și starea de oxidare prin culori, acest instrument oferă o reprezentare intuitivă a tendințelor periodice. Utilizarea tabelului periodic colorat în predarea chimiei poate îmbunătăți semnificativ înțelegerea studenților cu privire la conceptul de legătură chimică, reactivitate și comportamentul chimic al elementelor. În plus, poate servi ca un instrument valoros pentru cercetătorii și chimiștii din diverse domenii, oferind o imagine de ansamblu rapidă și clară a proprietăților chimice ale elementelor.
Articolul este bine scris și ușor de înțeles, oferind o introducere clară a conceptului de tabel periodic colorat și a utilității sale în vizualizarea tendințelor chimice. Totuși, ar fi util să se adauge o secțiune care să prezinte o analiză mai detaliată a modului în care electronii de valență influențează proprietățile chimice ale elementelor, inclusiv legăturile chimice și reacțiile chimice.
Articolul oferă o prezentare clară și concisă a conceptului de tabel periodic colorat, subliniind utilitatea sa în vizualizarea și înțelegerea tendințelor chimice. Explicația legăturii dintre electronii de valență și proprietățile chimice este bine argumentată și ușor de înțeles. Ar fi util să se adauge o secțiune care să prezinte diverse tipuri de tabele periodice colorate, cu exemple concrete de codificare a proprietăților chimice.
Articolul prezintă o introducere clară și concisă a conceptului de tabel periodic colorat, subliniind utilitatea sa în vizualizarea și înțelegerea tendințelor chimice. Explicația legăturii dintre electronii de valență și proprietățile chimice este bine argumentată și ușor de înțeles. Totuși, ar fi util să se adauge o secțiune care să ofere exemple concrete de utilizare a tabelului periodic colorat în diverse contexte, de exemplu, în predarea chimiei sau în cercetarea științifică.
Articolul prezintă o introducere clară și concisă a conceptului de tabel periodic colorat, subliniind utilitatea sa în vizualizarea și înțelegerea tendințelor chimice. Explicația legăturii dintre electronii de valență și proprietățile chimice este bine argumentată și ușor de înțeles. Totuși, ar fi util să se adauge o secțiune care să prezinte diverse aplicații practice ale tabelului periodic colorat, de exemplu, în industria chimică sau în domeniul medicinei.
Articolul prezintă o introducere clară și concisă a conceptului de tabel periodic colorat, subliniind utilitatea sa în vizualizarea și înțelegerea tendințelor chimice. Explicația legăturii dintre electronii de valență și proprietățile chimice este bine argumentată și ușor de înțeles. Totuși, ar fi util să se adauge o secțiune care să prezinte diverse resurse online și offline care oferă tabele periodice colorate, inclusiv link-uri către site-uri web și aplicații mobile.
Articolul oferă o prezentare clară și concisă a conceptului de tabel periodic colorat, subliniind utilitatea sa în vizualizarea și înțelegerea tendințelor chimice. Explicația legăturii dintre electronii de valență și proprietățile chimice este bine argumentată și ușor de înțeles. Ar fi util să se adauge o secțiune care să prezinte diverse metode de codificare a proprietăților chimice în tabelele periodice colorate, cu exemple concrete.
Articolul prezintă o introducere clară și concisă a conceptului de tabel periodic colorat, subliniind utilitatea sa în vizualizarea și înțelegerea tendințelor chimice. Explicația legăturii dintre electronii de valență și proprietățile chimice este bine argumentată și ușor de înțeles. Totuși, ar fi util să se adauge o secțiune care să prezinte o discuție mai aprofundată a avantajelor și dezavantajelor utilizării tabelului periodic colorat în diverse contexte.