Ecuația Nernst: Calculul potențialului celulei

Ecuația Nernst⁚ Calculul potențialului celulei
Ecuația Nernst este o ecuație fundamentală în electrochimie care permite calcularea potențialului celulei unei reacții electrochimice în condiții non-standard.
Introducere
Ecuația Nernst este un instrument esențial în electrochimie, permițând calcularea potențialului celulei unei reacții electrochimice în condiții non-standard. Această ecuație are o importanță majoră în diverse domenii, cum ar fi chimia analitică, biochimia și ingineria chimică. Potențialul celulei, cunoscut și ca forța electromotoare (FEM), este o măsură a tendinței unei reacții electrochimice de a avea loc spontan. În condiții standard, potențialul celulei este definit ca potențialul standard al celulei (E°). Cu toate acestea, în condiții non-standard, potențialul celulei variază în funcție de concentrația reactanților și produselor, precum și de temperatură.
Ecuația Nernst ne permite să calculăm potențialul celulei în aceste condiții non-standard, luând în considerare variațiile de concentrație și temperatură. Această ecuație este derivată din principiile termodinamicii și descrie relația dintre potențialul celulei și variația energiei libere Gibbs a reacției electrochimice.
Prin aplicarea ecuației Nernst, putem prezice direcția spontană a unei reacții electrochimice, calcula constanta de echilibru a reacției și analiza electrochimică a soluțiilor.
Fundamentele electrochimiei
Electrochimia este ramura chimiei care studiază relația dintre reacțiile chimice și energia electrică. Această disciplină se bazează pe principiile termodinamicii și se concentrează pe studiul transferului de electroni între specii chimice, care are loc la interfața dintre un conductor electronic (de obicei un metal) și un conductor ionic (de obicei o soluție).
Un concept central în electrochimie este cel al potențialului electrodului, care reprezintă tendința unui electrod de a accepta sau de a dona electroni. Potențialul electrodului este măsurat relativ la un electrod de referință, cel mai frecvent utilizat fiind electrodul standard de hidrogen (SHE). Potențialul standard al electrodului (E°) este definit ca potențialul electrodului la condiții standard, adică la o temperatură de 298 K (25 °C) și o concentrație de 1 mol/L pentru toate speciile implicate.
Reacțiile electrochimice sunt reacții redox, adică reacții care implică transferul de electroni. Aceste reacții pot fi clasificate în două categorii principale⁚ reacții de oxidare, în care o specie pierde electroni, și reacții de reducere, în care o specie câștigă electroni.
Celulele electrochimice
Celulele electrochimice sunt dispozitive care convertesc energia chimică în energie electrică (celule galvanice) sau invers (celule electrolitice). Aceste celule sunt formate din două electrozi, un anod și un catod, scufundați într-o soluție electrolitică. Anodul este electrodul unde are loc oxidarea, iar catodul este electrodul unde are loc reducerea.
Celulele galvanice, cunoscute și sub numele de celule voltaice, generează energie electrică prin reacții redox spontane. Aceste celule sunt utilizate în baterii și pile de combustie. Celulele electrolitice, pe de altă parte, utilizează energia electrică pentru a forța reacții redox nespontane. Aceste celule sunt utilizate în electroliză și în procesele de electrochimie industrială.
Un concept important în electrochimie este cel al potențialului celulei, care reprezintă diferența de potențial dintre cei doi electrozi ai unei celule electrochimice. Potențialul celulei este o măsură a tendinței unei reacții redox de a avea loc spontan.
Celula galvanică
O celulă galvanică, cunoscută și sub numele de celulă voltaică, este un dispozitiv electrochimic care convertește energia chimică în energie electrică prin reacții redox spontane. Aceste celule sunt formate din două jumătăți de celulă, fiecare conținând un electrod și un electrolitic. Cele două jumătăți de celulă sunt conectate printr-un circuit extern, care permite fluxul de electroni de la anod la catod.
Anodul este electrodul unde are loc oxidarea, eliberând electroni în circuitul extern. Catodul este electrodul unde are loc reducerea, acceptând electroni din circuitul extern. Soluția electrolitică din fiecare jumătate de celulă conține ioni care participă la reacțiile redox.
Un exemplu clasic de celulă galvanică este celula Daniell, care constă dintr-un electrod de cupru scufundat într-o soluție de sulfat de cupru (II) și un electrod de zinc scufundat într-o soluție de sulfat de zinc (II). Reacția globală a celulei Daniell este⁚
$$Zn(s) + Cu^{2+}(aq) ightleftharpoons Zn^{2+}(aq) + Cu(s)$$
În această reacție, zincul este oxidat la ioni de zinc (II), eliberând electroni care circulă prin circuitul extern către electrodul de cupru, unde ionii de cupru (II) sunt reduși la cupru metalic.
Celula electrolitică
O celulă electrolitică este un dispozitiv electrochimic care utilizează energie electrică pentru a provoca o reacție redox non-spontană. Spre deosebire de celulele galvanice, unde energia chimică este convertită în energie electrică, celulele electrolitice convertesc energia electrică în energie chimică.
În celulele electrolitice, un curent electric extern este aplicat pentru a forța o reacție redox non-spontană să aibă loc. Acest curent extern acționează ca o sursă de electroni, furnizând energia necesară pentru a depăși potențialul de echilibru al reacției.
Un exemplu clasic de celulă electrolitică este electroliza apei, unde apa este descompusă în hidrogen și oxigen prin aplicarea unui curent electric. Reacția globală a electrolizei apei este⁚
$$2H_2O(l) ightleftharpoons 2H_2(g) + O_2(g)$$
În această reacție, apa este oxidată la oxigen la anod, iar ionii de hidrogen sunt reduși la hidrogen gazos la catod.
Potențialul celulei
Potențialul celulei, denumit și forța electromotoare (EMF), este o măsură a tendinței unei reacții electrochimice de a avea loc. Este definit ca diferența de potențial electric dintre cei doi electrozi ai unei celule electrochimice. Potențialul celulei este un parametru important în electrochimie, deoarece poate fi utilizat pentru a prezice direcția și spontaneitatea unei reacții electrochimice.
Potențialul celulei este o măsură a energiei libere Gibbs a reacției electrochimice. O valoare pozitivă a potențialului celulei indică o reacție spontan, în timp ce o valoare negativă indică o reacție non-spontană.
Potențialul celulei poate fi exprimat prin următoarea ecuație⁚
$$E_{celulă} = E_{catod} ⸺ E_{anod}$$
unde $E_{celulă}$ este potențialul celulei, $E_{catod}$ este potențialul electrodului catodic și $E_{anod}$ este potențialul electrodului anodic.
Potențialul standard al electrodului
Potențialul standard al electrodului este potențialul unui electrod atunci când este în echilibru cu o soluție 1M a ionilor săi la o temperatură de 298K (25°C). Potențialul standard al electrodului este o valoare tabelată, care este specifică pentru fiecare electrod. Potențialul standard al electrodului este o măsură a tendinței unui electrod de a câștiga electroni. Cu cât este mai mare potențialul standard al electrodului, cu atât este mai mare tendința de a câștiga electroni.
Potențialul standard al electrodului este un concept important în electrochimie, deoarece poate fi utilizat pentru a prezice spontaneitatea unei reacții electrochimice. Un electrod cu un potențial standard al electrodului mai mare decât cel al altui electrod va acționa ca catod, în timp ce electrodul cu un potențial standard al electrodului mai mic va acționa ca anod.
Potențialul standard al electrodului este o valoare tabelată, care este specifică pentru fiecare electrod. Această valoare este utilizată ca punct de referință pentru a calcula potențialul celulei unei reacții electrochimice.
Ecuația Nernst
Ecuația Nernst este o ecuație importantă în electrochimie care leagă potențialul celulei unei reacții electrochimice de potențialul standard al electrodului, de concentrația reactanților și produselor și de temperatura. Ecuația Nernst este dată de următoarea ecuație⁚
$$E = E^o ⸺ rac{RT}{nF}lnQ$$
unde⁚
- $E$ este potențialul celulei
- $E^o$ este potențialul standard al celulei
- $R$ este constanta universală a gazelor ($8.314 J/mol.K$)
- $T$ este temperatura în Kelvin
- $n$ este numărul de electroni transferați în reacția electrochimică
- $F$ este constanta Faraday ($96485 C/mol$)
- $Q$ este coeficientul de reacție
Ecuația Nernst ne permite să calculăm potențialul celulei unei reacții electrochimice în condiții non-standard, adică atunci când concentrația reactanților și produselor diferă de 1M sau când temperatura diferă de 298K.
Aplicații ale ecuației Nernst
Ecuația Nernst are o gamă largă de aplicații în electrochimie, oferind o înțelegere aprofundată a potențialului celulei și a relației sale cu factorii chimici și fizici. Iată câteva aplicații importante ale ecuației Nernst⁚
- Calculul potențialului celulei⁚ Ecuația Nernst permite calcularea potențialului celulei pentru o reacție electrochimică în condiții non-standard, adică atunci când concentrația reactanților și produselor diferă de 1M sau când temperatura diferă de 298K.
- Determinarea constantei de echilibru⁚ Ecuația Nernst poate fi utilizată pentru a determina constanta de echilibru $K$ a unei reacții electrochimice. La echilibru, potențialul celulei este egal cu zero, iar ecuația Nernst devine⁚
$$E^o = rac{RT}{nF}lnK$$
- Analiza electrochimică⁚ Ecuația Nernst este esențială în analiza electrochimică, permițând determinarea concentrației speciilor chimice în soluție prin măsurarea potențialului celulei.
Aceste aplicații demonstrează importanța ecuației Nernst în diverse domenii ale electrochimiei, de la studiul reacțiilor electrochimice la analiza electrochimică și determinarea constantelor de echilibru.
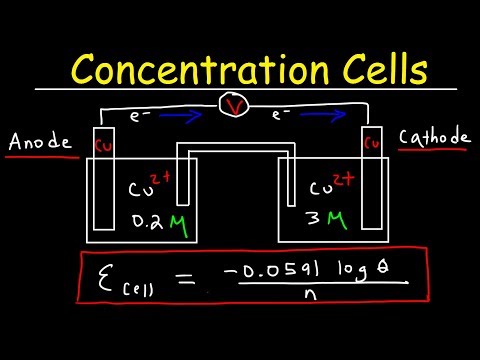
Calculul potențialului celulei
O aplicație majoră a ecuației Nernst este calcularea potențialului celulei unei reacții electrochimice în condiții non-standard. Potențialul celulei este o măsură a tendinței unei reacții electrochimice de a avea loc. Ecuația Nernst leagă potențialul celulei $E$ de potențialul standard al celulei $E^o$, constanta de gaz ideală $R$, temperatura $T$, numărul de electroni transferați $n$, constanta lui Faraday $F$, și concentrațiile reactanților și produselor. Formula ecuației Nernst este⁚
$$E = E^o ⸺ rac{RT}{nF}lnQ$$
unde $Q$ este coeficientul de reacție, care este o măsură a concentrației reactanților și produselor la un moment dat.
Pentru a calcula potențialul celulei, trebuie să cunoaștem potențialul standard al celulei, temperatura, numărul de electroni transferați și concentrațiile reactanților și produselor. De exemplu, dacă dorim să calculăm potențialul celulei unei celule galvanice formată din electrozi de cupru și zinc, trebuie să cunoaștem potențialul standard al celulei $E^o$, care este 1,10 V, temperatura, care este 298K, numărul de electroni transferați, care este 2, și concentrațiile ionilor de cupru și zinc. Folosind ecuația Nernst, putem calcula potențialul celulei în condiții non-standard.
Determinarea constantei de echilibru
Ecuația Nernst poate fi utilizată și pentru a determina constanta de echilibru $K$ a unei reacții electrochimice. Constanta de echilibru este o măsură a poziției de echilibru a unei reacții reversibile, indicând raportul dintre concentrațiile produselor și reactanților la echilibru. Relația dintre constanta de echilibru și potențialul standard al celulei este dată de ecuația⁚
$$K = exp( rac{nFE^o}{RT})$$
Această ecuație arată că constanta de echilibru este direct proporțională cu potențialul standard al celulei. Cu alte cuvinte, cu cât potențialul standard al celulei este mai mare, cu atât constanta de echilibru este mai mare și reacția este mai favorabilă din punct de vedere termodinamic.
Pentru a determina constanta de echilibru, trebuie să cunoaștem potențialul standard al celulei, temperatura și numărul de electroni transferați. De exemplu, dacă dorim să determinăm constanta de echilibru pentru reacția de formare a ionilor de argint din argint metalic, trebuie să cunoaștem potențialul standard al celulei pentru această reacție, care este 0,80 V, temperatura, care este 298K, și numărul de electroni transferați, care este 1. Folosind ecuația de mai sus, putem calcula constanta de echilibru pentru această reacție.
Analiza electrochimică
Ecuația Nernst joacă un rol crucial în analiza electrochimică, o ramură a chimiei care se ocupă cu studiul relației dintre fenomenele electrice și reacțiile chimice. Această ecuație permite determinarea concentrației unei specii chimice într-o soluție prin măsurarea potențialului celulei. De exemplu, în potențiometria, o tehnică electroanalitică, se folosește o celulă electrochimică pentru a măsura potențialul unei soluții necunoscute. Folosind ecuația Nernst, potențialul măsurat poate fi corelat cu concentrația speciei chimice de interes.
Ecuația Nernst este utilizată și în alte tehnici electroanalitice, cum ar fi voltametria și amperometria. Voltametria implică măsurarea curentului electric în funcție de potențialul aplicat, în timp ce amperometria implică măsurarea curentului electric la un potențial constant. În ambele tehnici, ecuația Nernst poate fi utilizată pentru a interpreta datele experimentale și a determina concentrația speciei chimice de interes.
Prin urmare, ecuația Nernst este un instrument esențial în analiza electrochimică, permițând determinarea concentrației, studiul cineticii reacțiilor electrochimice și caracterizarea materialelor electrochimice.
Concluzie
Ecuația Nernst este un instrument fundamental în electrochimie, care permite calcularea potențialului celulei unei reacții electrochimice în condiții non-standard. Această ecuație are aplicații largi în diverse domenii, inclusiv calculul potențialului celulei, determinarea constantei de echilibru și analiza electrochimică. Ecuația Nernst demonstrează relația strânsă dintre termodinamica și electrochimia, oferind o înțelegere aprofundată a comportamentului reacțiilor electrochimice.
Prin aplicarea ecuației Nernst, putem prezice și controla potențialul celulei, ceea ce este esențial pentru proiectarea și optimizarea dispozitivelor electrochimice, cum ar fi bateriile, celulele de combustibil și senzori electrochimici. De asemenea, ecuația Nernst ne permite să determinăm concentrația speciilor chimice în soluții, contribuind la dezvoltarea tehnicilor electroanalitice pentru analiza chimică.
În concluzie, ecuația Nernst este o ecuație fundamentală care joacă un rol crucial în înțelegerea și aplicarea electrochimiei, având o importanță majoră în diverse domenii științifice și tehnologice.
Articolul prezintă o introducere clară și concisă în ecuația Nernst, evidențiind importanța sa în diverse domenii ale chimiei. Explicațiile fundamentale ale electrochimiei sunt prezentate într-un mod accesibil, oferind o bază solidă pentru înțelegerea ecuației. Totuși, ar fi benefic de adăugat exemple concrete de aplicații ale ecuației Nernst în diverse contexte practice, pentru a ilustra mai bine utilitatea sa.
Articolul abordează tema ecuației Nernst într-un mod sistematic, oferind o perspectivă detaliată asupra principiilor sale de bază. Explicațiile sunt clare și concise, iar diagrama utilizată pentru a ilustra conceptul potențialului celulei este foarte utilă. Ar fi util de adăugat o secțiune care să exploreze aplicațiile ecuației Nernst în contextul bateriilor și celulelor electrochimice.
Articolul oferă o introducere excelentă în ecuația Nernst, evidențiind importanța sa în electrochimie. Explicațiile sunt clare și concise, iar diagrama utilizată pentru a ilustra conceptul potențialului celulei este foarte utilă. Ar fi benefic de adăugat o secțiune care să exploreze relația dintre ecuația Nernst și principiile termodinamicii, pentru a oferi o înțelegere mai profundă a fundamentelor sale teoretice.
Articolul abordează tema ecuației Nernst într-un mod sistematic, oferind o perspectivă detaliată asupra principiilor sale de bază. Explicațiile sunt clare și concise, iar diagrama utilizată pentru a ilustra conceptul potențialului celulei este foarte utilă. Ar fi util de adăugat o secțiune dedicată derivării ecuației Nernst, pentru a oferi o înțelegere mai profundă a fundamentelor sale matematice.
Articolul prezintă o prezentare clară și concisă a ecuației Nernst, evidențiind importanța sa în electrochimie. Explicațiile sunt ușor de înțeles, iar exemplele oferite sunt relevante pentru subiect. Ar fi benefic de adăugat o secțiune care să exploreze aplicațiile practice ale ecuației Nernst în diverse domenii, cum ar fi chimia analitică sau biochimia.
Articolul este bine structurat și prezintă o introducere convingătoare în subiectul ecuației Nernst. Explicațiile sunt clare și accesibile, iar exemplele oferite sunt relevante pentru înțelegerea conceptului. Ar fi util de adăugat o secțiune care să exploreze limitele de aplicare ale ecuației Nernst, precum și factorii care pot afecta acuratețea calculelor.
Articolul prezintă o introducere clară și concisă în ecuația Nernst, evidențiind importanța sa în diverse domenii ale chimiei. Explicațiile fundamentale ale electrochimiei sunt prezentate într-un mod accesibil, oferind o bază solidă pentru înțelegerea ecuației. Ar fi benefic de adăugat o secțiune care să exploreze implicațiile ecuației Nernst în contextul reacțiilor electrochimice reversibile și ireversibile.
Articolul oferă o introducere excelentă în ecuația Nernst, evidențiind importanța sa în electrochimie. Explicațiile sunt clare și concise, iar diagrama utilizată pentru a ilustra conceptul potențialului celulei este foarte utilă. Ar fi benefic de adăugat o secțiune care să exploreze relația dintre ecuația Nernst și alte concepte importante din electrochimie, cum ar fi potențialul standard al celulei sau constanta de echilibru.
Articolul este bine structurat și prezintă o introducere convingătoare în subiectul ecuației Nernst. Explicațiile sunt clare și accesibile, iar exemplele oferite sunt relevante pentru înțelegerea conceptului. Ar fi util de adăugat o secțiune care să exploreze impactul variației temperaturii asupra potențialului celulei, conform ecuației Nernst.