Tabelul periodic al elementelor

Introducere
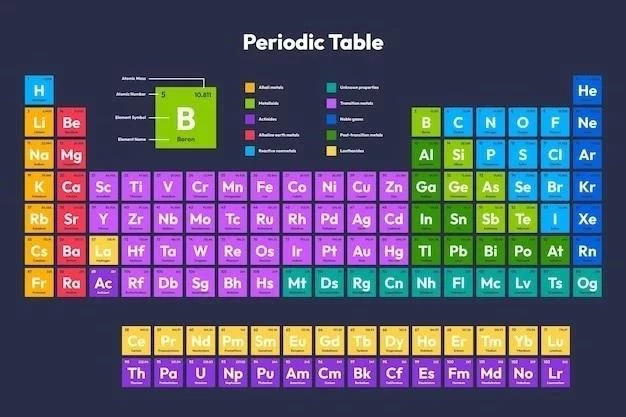
Tabelul periodic al elementelor este o reprezentare sistematică a tuturor elementelor chimice cunoscute, organizate în funcție de proprietățile lor chimice și fizice.
Importanța tabelului periodic
Tabelul periodic este un instrument esențial în chimie, oferind o bază pentru înțelegerea proprietăților elementelor chimice și a modului în care acestea interacționează. Organizarea elementelor în funcție de numărul atomic ($Z$) și de configurația electronică permite prezicerea comportamentului chimic și a proprietăților fizice ale elementelor, facilitând astfel studiul și aplicarea chimiei.
Organizarea elementelor
Elementele din tabelul periodic sunt aranjate în funcție de numărul atomic crescător, care reprezintă numărul de protoni din nucleul unui atom. Elementele cu proprietăți chimice similare sunt grupate în coloane verticale numite grupuri sau familii. Liniile orizontale din tabelul periodic se numesc perioade și indică numărul de niveluri de energie ale electronilor din atomii elementelor respective.
Clasificarea elementelor
Elementele din tabelul periodic pot fi clasificate în trei categorii principale⁚ metale, nemetale și metaloizi.
Metale
Metalele sunt elementele chimice care prezintă, în general, caracteristici precum conductivitatea electrică și termică ridicată, maleabilitatea, ductilitatea și luciul metalic. Acestea sunt, de obicei, solide la temperatura camerei (cu excepția mercurului), cu excepția unor excepții, cum ar fi sodiul și potasiul, care sunt moi și reacționează violent cu apa. Metalele se găsesc în stânga și în centrul tabelului periodic.
Nemetale
Nemetalele sunt elementele chimice care se caracterizează prin proprietăți opuse metalelor. Acestea au o conductivitate electrică și termică scăzută, sunt fragile și nu prezintă luciul metalic. Majoritatea nemetalelor sunt gaze la temperatura camerei (de exemplu, oxigenul, azotul), dar există și nemetale solide (de exemplu, carbonul, fosforul) și lichide (de exemplu, bromul). Nemetalele se găsesc în partea dreaptă a tabelului periodic.
Metaloizi
Metaloizii, cunoscuți și sub numele de semimetale, sunt elemente chimice care prezintă proprietăți intermediare între metale și nemetale. Acestea au o conductivitate electrică variabilă, pot fi fragile sau ductile, iar aspectul lor poate fi metalic sau nemetalic. Metaloizii se găsesc pe linia de separare dintre metale și nemetale în tabelul periodic. Exemple de metaloizi includ siliciul, germaniul și arsenul, care sunt utilizate pe scară largă în industria electronică și a semiconductorilor.
Proprietățile elementelor
Proprietățile elementelor chimice sunt determinate de structura lor atomică și de modul în care atomii interacționează între ei.
Proprietăți fizice
Proprietățile fizice ale elementelor descriu caracteristicile lor observabile, cum ar fi starea de agregare, culoarea, densitatea, punctul de topire și punctul de fierbere. Aceste proprietăți sunt importante pentru a înțelege comportamentul elementelor în diverse condiții și pentru a le identifica. De exemplu, metalele sunt în general solide la temperatura camerei, au o densitate mare și sunt bune conducătoare de căldură și electricitate. Nemetalele, pe de altă parte, pot fi solide, lichide sau gaze, au densități variabile și sunt, în general, izolatoare.
Conductivitate
Conductivitatea este o măsură a capacității unui material de a conduce căldura sau electricitatea. Metalele sunt excelente conducătoare de căldură și electricitate, datorită prezenței electronilor liberi în structura lor atomică. Acești electroni pot circula liber, transportând energia termică sau electrică. Nemetalele, în general, sunt izolatoare, având o conductivitate termică și electrică scăzută. Metaloizii prezintă o conductivitate intermediară, comportându-se ca semiconductori în anumite condiții.
Malleabilitate
Malleabilitatea se referă la capacitatea unui material de a fi deformat prin batere sau presare fără a se sfărâma. Metalele sunt de obicei foarte malleabile, permițând formarea de foi subțiri sau discuri. Această proprietate este determinată de legăturile metalice care permit atomilor de metal să se deplaseze relativ ușor fără a rupe legăturile. Nemetalele și metaloizii sunt în general fragili și nu sunt malleabili.
Ductilitate
Ductilitatea se referă la capacitatea unui material de a fi tras în fire subțiri fără a se rupe. Metalele sunt în general foarte ductile, datorită legăturilor metalice care permit atomilor de metal să se deplaseze relativ ușor fără a rupe legăturile. Această proprietate este esențială pentru fabricarea de cabluri electrice, fire și alte produse cu formă alungită. Nemetalele și metaloizii sunt în general fragili și nu sunt ductile.
Proprietăți chimice
Proprietățile chimice ale elementelor se referă la modul în care acestea interacționează cu alte substanțe pentru a forma noi compuși. Metalele tind să formeze cationi prin pierderea de electroni, iar nemetalele tind să formeze anioni prin câștigarea de electroni. Metaloizii pot prezenta ambele tipuri de comportament chimic, în funcție de condițiile specifice. Reactivitatea chimică a elementelor este influențată de o serie de factori, inclusiv de configurația electronică și de energia de ionizare.
Reactivitate
Reactivitatea chimică a unui element se referă la ușurința cu care acesta reacționează cu alte substanțe. Metalele alcaline și alcalino-pământoase sunt foarte reactive, în timp ce metalele nobile, cum ar fi aurul și platina, sunt foarte puțin reactive. Nemetalele prezintă o gamă largă de reactivitate, de la foarte reactive, cum ar fi halogenii, la foarte puțin reactive, cum ar fi gazele nobile. Reactivitatea metaloizilor este intermediară între metale și nemetale.
Stări de oxidare
Starea de oxidare a unui atom reprezintă sarcina formală pe care o are atomul într-o moleculă sau ion. Metalele au de obicei stări de oxidare pozitive, în timp ce nemetalele pot avea stări de oxidare pozitive sau negative, în funcție de elementul cu care se leagă. Metaloizii pot avea stări de oxidare variabile, în funcție de contextul chimic. Starea de oxidare a unui element poate fi prezisă pe baza poziției sale în tabelul periodic.
Structura atomică
Înțelegerea structurii atomice este esențială pentru a explica proprietățile chimice și fizice ale elementelor.
Numărul atomic ($Z$)
Numărul atomic ($Z$) reprezintă numărul de protoni din nucleul unui atom. Protonii sunt particule subatomice cu sarcină pozitivă, iar numărul lor definește identitatea unui element. De exemplu, un atom de hidrogen are un singur proton ($Z = 1$), în timp ce un atom de carbon are șase protoni ($Z = 6$). Numărul atomic este un număr întreg pozitiv și este specific fiecărui element din tabelul periodic.
Masa atomică ($A$)
Masa atomică ($A$) a unui element reprezintă masa medie a atomilor acelui element, exprimată în unități de masă atomică (u.a.m.). Masa atomică este determinată de suma maselor protonilor și neutronilor din nucleul atomului. Neutronii sunt particule subatomice neutre din punct de vedere electric, iar masa lor este similară cu cea a protonilor. Masa atomică este un număr real, care poate fi un număr întreg sau un număr zecimal, și este specific fiecărui element din tabelul periodic.
Simboluri chimice
Simbolurile chimice sunt abrevieri de o sau două litere care reprezintă elementele chimice. Prima literă a simbolului este întotdeauna majusculă, iar a doua literă, dacă există, este minusculă. De exemplu, simbolul chimic al hidrogenului este H, iar simbolul chimic al oxigenului este O. Simbolurile chimice sunt utilizate în formule chimice, ecuații chimice și alte notații chimice pentru a reprezenta elementele chimice.
Formule chimice
Formulele chimice sunt reprezentări simbolice ale compușilor chimici. Acestea indică tipurile și numărul de atomi din fiecare element prezent într-o moleculă. De exemplu, formula chimică a apei este $H_2O$, indicând faptul că o moleculă de apă conține doi atomi de hidrogen (H) și un atom de oxigen (O). Formulele chimice sunt esențiale pentru descrierea și înțelegerea reacțiilor chimice.
Proprietăți periodice
Proprietățile periodice ale elementelor variază în mod regulat pe parcursul tabelului periodic, reflectând tendințele în configurația electronică a atomilor.
Electronegativitate
Electronegativitatea este o măsură a tendinței unui atom de a atrage electroni într-o legătură chimică. Valorile electronegativității cresc de-a lungul unei perioade din tabelul periodic, deoarece sarcina nucleară efectivă crește, iar electronii de valență sunt mai strâns legați de nucleu. Pe un grup, electronegativitatea scade, deoarece electronii de valență sunt mai departe de nucleu și sunt mai ușor de îndepărtat.
Energia de ionizare
Energia de ionizare este energia minimă necesară pentru a elimina un electron dintr-un atom gazos în starea sa fundamentală. Această proprietate periodică crește de-a lungul unei perioade, deoarece sarcina nucleară efectivă crește, ceea ce face ca electronii să fie mai strâns legați de nucleu. Pe un grup, energia de ionizare scade, deoarece electronii de valență sunt mai departe de nucleu și sunt mai ușor de îndepărtat.
Afinitatea electronică
Afinitatea electronică este energia schimbată atunci când un atom gazos în starea sa fundamentală capătă un electron, formând un ion negativ. Această proprietate periodică crește de-a lungul unei perioade, deoarece sarcina nucleară efectivă crește, ceea ce face ca atomul să fie mai atractiv pentru un electron suplimentar. Pe un grup, afinitatea electronică scade, deoarece electronii de valență sunt mai departe de nucleu și sunt mai puțin atrași de acesta.
Electroni de valență
Electronii de valență sunt electronii din învelișul electronic exterior al unui atom, care sunt implicați în formarea legăturilor chimice. Numărul electronilor de valență determină comportamentul chimic al unui element, deoarece aceștia sunt cei care interacționează cu alți atomi. Electronii de valență sunt cei mai puțin legați de nucleu și sunt cei mai ușor de îndepărtat sau de împărțiți în timpul reacțiilor chimice.
Legături chimice
Legăturile chimice sunt forțele care țin atomii împreună în molecule și compuși.
Legături metalice
Legăturile metalice sunt un tip de legătură chimică care se formează între atomii metalelor. În metale, electronii de valență sunt delocalizați, formând o „mare electronică” care se extinde pe tot cristalul metalic. Această delocalizare a electronilor permite metalelor să conducă electricitatea și căldura cu ușurință. De asemenea, contribuie la proprietățile metalelor, cum ar fi maleabilitatea și ductilitatea.
Legături covalente
Legăturile covalente se formează prin împărțirea perechilor de electroni între doi atomi. Această împărțire a electronilor creează o forță atractivă între atomi, formând o legătură stabilă. Legăturile covalente pot fi simple, duble sau triple, în funcție de numărul de perechi de electroni împărțiți. Legăturile covalente sunt responsabile pentru formarea unei varietăți largi de molecule, de la cele simple, cum ar fi apa ($H_2O$), la cele complexe, cum ar fi proteinele.
Legături ionice
Legăturile ionice se formează prin transferul de electroni de la un atom la altul. Atomul care pierde electroni devine un ion pozitiv (cation), iar atomul care câștigă electroni devine un ion negativ (anion). Forța atractivă electrostatică dintre cationi și anioni formează o legătură ionică. Legăturile ionice sunt responsabile pentru formarea compușilor ionici, cum ar fi clorura de sodiu ($NaCl$), care este o sare obișnuită.
Aplicații ale elementelor
Elementele chimice au o gamă largă de aplicații în diverse domenii, de la industria de construcții la tehnologie și medicină.
Metale în industrie și tehnologie
Metalele joacă un rol esențial în diverse industrii și tehnologii. De exemplu, fierul este utilizat pe scară largă în construcții, automobile și producția de oțel, aluminiul este apreciat pentru ușurința sa și rezistența la coroziune, iar cuprul este un conductor excelent de electricitate, utilizat în cabluri electrice și componente electronice. Metalele prețioase, cum ar fi aurul și platina, sunt utilizate în bijuterii, electronică și medicină.
Nemetale în industrie și tehnologie
Nemetalele sunt la fel de importante ca metalele în diverse industrii și tehnologii. De exemplu, oxigenul este esențial pentru respirație și combustie, azotul este utilizat în producția de îngrășăminte și explozivi, iar clorul este folosit pentru purificarea apei și în producția de materiale plastice. Carbonul este un element fundamental, formând baza vieții și având aplicații diverse, de la combustibili la materiale compozite.
Metaloizi în industrie și tehnologie
Metaloizii, cu proprietățile lor intermediare între metale și nemetale, joacă un rol crucial în diverse industrii și tehnologii. Siliciul, de exemplu, este un component esențial în fabricarea semiconductorilor, a panourilor solare și a sticlei. Germaniul, folosit în fabricarea tranzistorilor și a detectorilor de radiații, este un alt metaloid important. Arsenul și antimoniul sunt utilizate în fabricarea aliajelor și a materialelor semiconductoare.
Concluzie
Înțelegerea tabelului periodic este esențială pentru progresul științific și tehnologic, oferind o bază solidă pentru explorarea și descoperirea elementelor.
Importanța înțelegerii tabelului periodic
Tabelul periodic este un instrument fundamental în chimie, oferind o perspectivă asupra proprietăților elementelor și a modului în care acestea interacționează. Înțelegerea organizării elementelor în funcție de numărul atomic, masa atomică și proprietățile periodice permite prezicerea comportamentului chimic al elementelor și dezvoltarea de noi materiale și tehnologii. Tabelul periodic este o hartă a chimiei, facilitând studierea și aplicarea cunoștințelor din acest domeniu.
Cercetare și dezvoltare viitoare
Cercetările viitoare în domeniul tabelului periodic se vor concentra pe explorarea proprietăților elementelor mai puțin cunoscute, precum elementele transuraniene. De asemenea, se vor căuta noi aplicații ale elementelor existente, cum ar fi dezvoltarea de materiale cu proprietăți îmbunătățite, cum ar fi superconductivitate la temperatura camerei, sau utilizarea elementelor pentru stocarea energiei. Înțelegerea profundă a tabelului periodic este esențială pentru a aborda provocările globale, cum ar fi schimbările climatice și dezvoltarea de tehnologii sustenabile.
Articolul prezintă o prezentare generală a tabelului periodic, cu o structură logică și clară. Descrierea organizării elementelor în funcție de numărul atomic și configurația electronică este concisă și ușor de înțeles. Recomand adăugarea unor informații despre tendințele periodice, cum ar fi raza atomică, energia de ionizare și afinitatea electronică, pentru a oferi o perspectivă mai amplă asupra comportamentului elementelor.
Articolul este bine scris și informativ, oferind o introducere clară și concisă a tabelului periodic. Descrierea proprietăților metalelor și nemetalelor este relevantă și ușor de înțeles. Sugerez adăugarea unor informații despre istoria tabelului periodic, inclusiv contribuția lui Dmitri Mendeleev la dezvoltarea sa.
Articolul este bine scris și informativ, oferind o introducere clară și concisă a tabelului periodic. Descrierea proprietăților metalelor și nemetalelor este relevantă și ușor de înțeles. Sugerez adăugarea unor informații despre aplicațiile practice ale elementelor chimice, pentru a oferi o perspectivă mai amplă asupra importanței tabelului periodic.
Articolul prezintă o introducere clară și concisă a tabelului periodic, evidențiind importanța sa în chimie. Organizarea elementelor în funcție de numărul atomic și configurația electronică este explicată succint, facilitând înțelegerea conceptului. De asemenea, clasificarea elementelor în metale, nemetale și metaloizi este prezentată clar și concis, cu exemple relevante. Apreciez abordarea didactică a articolului, care îl face accesibil unui public larg.
Articolul este bine structurat și ușor de înțeles, oferind o introducere bună în tabelul periodic. Apreciez modul în care sunt prezentate proprietățile metalelor și nemetalelor, cu exemple concrete. Sugerez adăugarea unor informații despre aplicațiile practice ale elementelor chimice, pentru a oferi o perspectivă mai amplă asupra importanței tabelului periodic.
Articolul prezintă o prezentare generală a tabelului periodic, cu o structură clară și concisă. Descrierea organizării elementelor în funcție de numărul atomic și configurația electronică este ușor de înțeles. Recomand adăugarea unor informații despre importanța tabelului periodic în diverse domenii, cum ar fi industria, medicina și agricultura.
Articolul oferă o prezentare generală bine structurată a tabelului periodic, acoperind aspectele cheie ale organizării și clasificării elementelor. Descrierea proprietăților metalelor și nemetalelor este clară și concisă, cu exemple relevante. Recomand adăugarea unor informații suplimentare despre metaloizi, inclusiv exemple de utilizare a acestora în diverse domenii.
Articolul prezintă o imagine de ansamblu a tabelului periodic, cu o structură logică și clară. Descrierea organizării elementelor în funcție de numărul atomic și configurația electronică este concisă și ușor de înțeles. Recomand adăugarea unor diagrame sau imagini pentru a ilustra mai bine conceptul de tabel periodic și pentru a facilita înțelegerea.
Articolul este informativ și bine structurat, oferind o introducere bună în tabelul periodic. Descrierea proprietăților metalelor și nemetalelor este concisă și relevantă. Sugerez adăugarea unor informații despre istoria tabelului periodic, inclusiv contribuția lui Dmitri Mendeleev la dezvoltarea sa.
Articolul este bine scris și ușor de înțeles, oferind o introducere excelentă în tabelul periodic. Apreciez modul în care sunt prezentate proprietățile metalelor și nemetalelor, cu exemple concrete. Sugerez adăugarea unor informații despre tendințele periodice, cum ar fi electronegativitatea, energia de ionizare și afinitatea electronică, pentru a oferi o perspectivă mai amplă asupra comportamentului elementelor.